
- •Квантово-механическая модель атома водорода.
- •Периодическая система элементов д.И.Менделеева.
- •Теория химического строения
- •Химическая связь. Основные характеристики химической связи
- •Ковалентная связь
- •Полярная и неполярная ковалентная связь
- •Водородная связь
- •Типы химических связей. Межмолекулярные взаимодействия.
- •Растворы, концентрация растворов, способы выражения.
- •Самостоятельная работа №1
Полярная и неполярная ковалентная связь
По симметрии распределения заряда ковалентные связи делятся на полярные и неполярные.
Если общая электронная пара (область перекрывания орбиталей) расположена симметрично относительно связанных ядер, связь называется ковалентной неполярной, если смещена в сторону одного из ядер – ковалентной полярной.
Ковалентная неполярная связь возникает между атомами одного и того же элемента, при этом из-за симметрии распределения зарядов связь не обладает дипольным моментом. Примеры молекул с неполярной ковалентной связью: H2, O2, F2,Cl2, N2, Ag2 .
Если участвующие в образовании связи атомы отличаются по электроотрицательности, то возникает ковалентная полярная связь. Общая электронная пара смещена в сторону атома с большей электроотрицательностью, возникающая в результате асимметрия в распределении зарядов приводит к появлению у связи дипольного момента.Часто смещение электронной пары показывают стрелкой, например:
![]()
Символом ![]() обозначены
дипольные заряды, которые могут быть
меньше заряда электрона, но существуют
только совместно.
обозначены
дипольные заряды, которые могут быть
меньше заряда электрона, но существуют
только совместно.
Электроотрицательность атома углерода зависит от его гибридизации, в таблице для сравнения приведены относительные электроотрицательности некоторых атомов и гибридных состояний углерода:
F |
O |
C sp |
N |
Cl |
Br |
C sp2 |
I |
C sp3 |
S |
H |
4,0 |
3,5 |
3,2 |
3,0 |
3,0 |
2,8 |
2,8 |
2,6 |
2,5 |
2,5 |
2,1 |
![]() -
и
-
и ![]() -связи
-связи
- и -связи различают по симметрии перекрывания орбиталей.
Если линия, соединяющая ядра связанных атомов проходит через область перекрывания орбиталей, связь называется -связью, если область перекрывания лежит в стороне от этой линии - -связью.
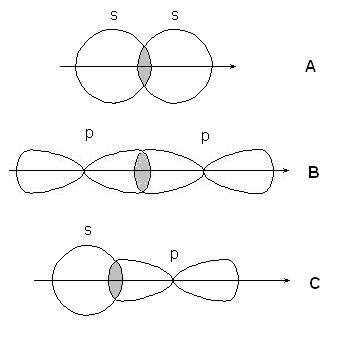
-связи образуются при перекрывании s-s орбиталей атомов (А), р-p орбиталей (В), s-p орбиталей (С) и гибридных орбиталей:
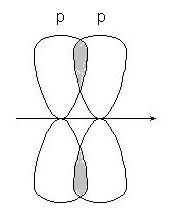
-связи - при перекрывании р-р орбиталей:
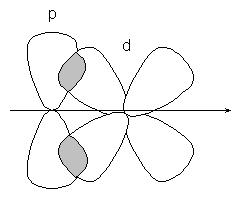
или р-d орбиталей:
-связь менее прочна, чем -связь, ее электроны легче подвержены внешнему воздействию. В соединениях с кратными связями только одна из связей является -cвязью, образованная перекрыванием s, р или гибридных орбиталей, а остальные - -связями, образованными перекрыванием негибридизованных р – орбиталей атомов, например, двойная связь, образованная гибридными орбиталями ( -связь) и не участвующими в гибридизации р-орбиталями ( -связь):
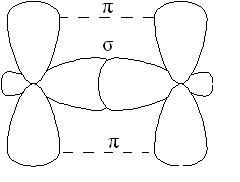
В молекулах алкенов, в частности этилена, атомы углерода при двойнойсвязи находятся в состоянии sp2-гибридизации, все С-Н иС-С -связи лежат в одной плоскости, перекрывание негибридных р-орбиталей атомов углеродапроисходит в плоскости, перпендикулярной плоскости -связей. Иногда эту плоскостьназывают плоскостью -связи:
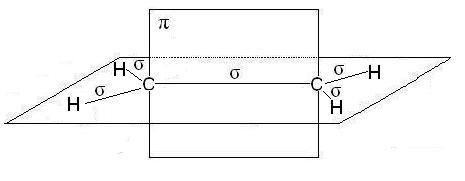
В случае тройной связи, например в молекулах алкинов, например, ацетилена, атомы углерода при связи имеют sp-гибридизацию, Две -связи, образованные перекрыванием негибридных р-орбиталей атомов углерода ( по две от каждого) лежат в двух взаимно перпендикулярных плоскостях:
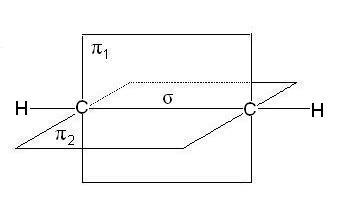
В таблице приведены основные характеристики связей между атомами углерода:
Связь |
Гибридизация |
Длина (нм) |
Энергия (кДж/моль) |
C |
sp3 |
0,154 |
347 |
C |
sp2 |
0,134 |
606 |
C |
sp |
0,120 |
828 |
