
- •Квантово-механическая модель атома водорода.
- •Периодическая система элементов д.И.Менделеева.
- •Теория химического строения
- •Химическая связь. Основные характеристики химической связи
- •Ковалентная связь
- •Полярная и неполярная ковалентная связь
- •Водородная связь
- •Типы химических связей. Межмолекулярные взаимодействия.
- •Растворы, концентрация растворов, способы выражения.
- •Самостоятельная работа №1
Теория химического строения
Химическим строением называется последовательность соединения атомов в молекуле и их взаимное расположение в пространстве. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
Основные положения теории химического строения:
1. Свойства веществ определяются его качественным и количественным составом и химическим строением.
2. Атомы в молекуле соединияются в соответствии с их валентностью.
3. Атомы и группы атомов в молекуле влияют друг на друга, это влияние ослабевает по мере их взаимного удаления.
Теория химического строения разработана А.М. Бутлеровым и его учениками во второй половине XIX века.
Химическая связь. Основные характеристики химической связи
Химической связью называют взаимодействие, удерживающее атомы в молекулах и обуславливающее стабильность молекул в определенных условиях.
Основные характеристики химической связи:
Энергия связи (ЕСВ ) – минимальная энергия, необходимая для разрушения связи.
Измеряется в электронвольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Энергия связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь.
Длина связи (LСВ )– расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее.
Насыщаемость связи – если атом образует конечное число связей с другими атомами (обычно не более 8) – связь насыщаема, если бесконечно большое (больше 1000) – ненасыщаема.
Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие связи, то связь направлена, если таких направлений нет – то ненаправлена.
Энергия и длина связи характерны для любой химической связи, насыщаемость и направленность зависят от вида связи.
Ковалентная связь
Ковалентная связь – связь между атомами за счет общих электронных пар.
При сближении двух атомов водорода возможно два случая:
1. по мере сближения силы отталкивания между атомами неограниченно возрастают (кривая 1), при этом энергия системы увеличивается и система не может быть устойчивой.
2. силы отталкивания сменяются силами притяжения, которые достигают максимума при расстоянии между ядрами, равном ro(кривая 2), энергия системы в этом состоянии минимальная и меньше суммарной энергии исходных атомов.
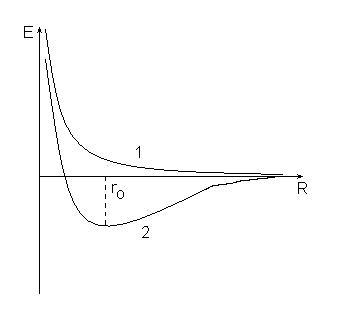
Такое отличие в поведении атомов вызвано разными значениями спинового квантового числа для электронов в исходных атомах. Если спины электронов были одинаковыми, то это кривая 1, если разными – то 2:
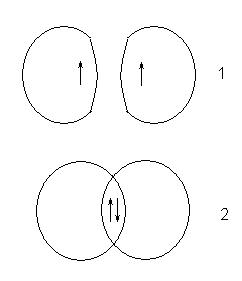
Состояние, которое при этом возникает, соответствует устойчивой системе, в которой между ядрами атомов существует область с повышенной электронной плотностью. Эта область компенсирует взаимное отталкивание ядер и называется областью перекрывания орбиталей или общей электронной парой.
Так образуется молекула водорода. Так как ориентация спина электрона в атоме водорода равновероятна (половина атомов имеет электрон со спином +1/2, половина -1/2), при образовании молекулярного водорода из атомарного все атомы образуют молекулы.
Часто этот процесс изображают в виде схемы, обозначая электроны точками:
![]()
а общую электронную пару – чертой:
![]()
Ковалентная связь образуется по двум механизмам – обменному, когда каждый из участвующих в образовании связи атомов предоставляет для общей электронной пары по одному электрону (А) и донорно-акцепторный, когда донор дает электронную пару, а акцептор – свободную орбиталь (В). На рисунке приведены схемы этих механизмов и соотвествующие им реально протекающие реакции:
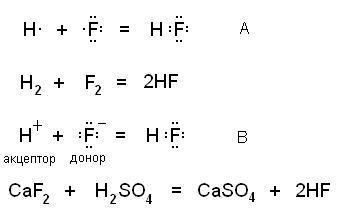
Образующиеся в результате молекулы ничем друг от друга не отличаются.
