- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
Реакции замещения
К реакциям замещения относятся реакции галогенирования, нитрования, сульфогалогенирования, сульфоокисления.
1. Галогенирование. Галогенирование - реакция замещения атома водорода на галоген (чаще всего Cl, Br). Основным условием протекания реакции является УФ - излучение или температура (250 - 400С) (инициирование).
По реакционной способности галогены располагаются в следующем порядке: Cl Br I
![]()
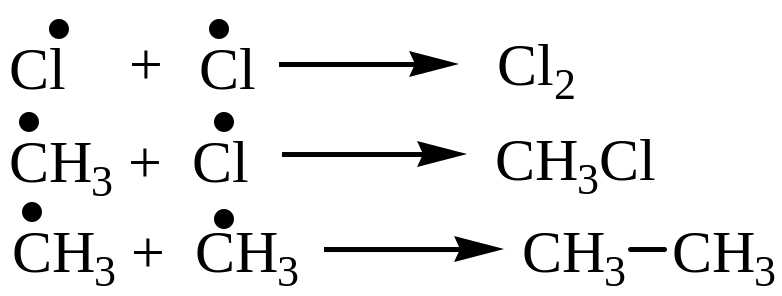
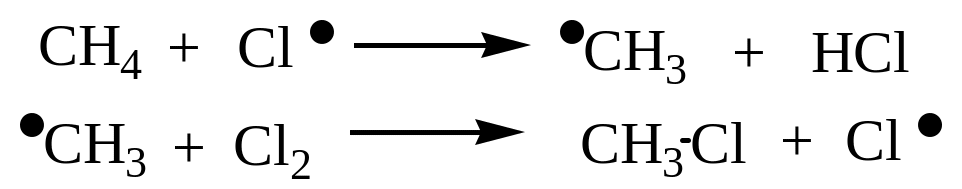
Хлорирование метана - цепной радикальный процесс:
Стадия 1 – зарождение цепи (инициирование):
![]()
Стадия 2 – рост цепи:
Стадия 3 – обрыв цепи:
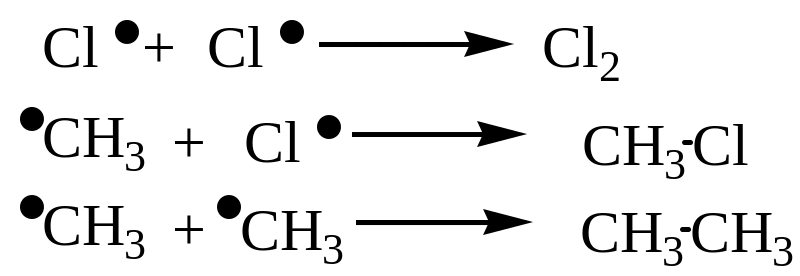
При галогенировании изобутана образуется смесь изомеров – 2-хлор-2-метилпропана (64%) и 2-метилхлорпропана (36%)
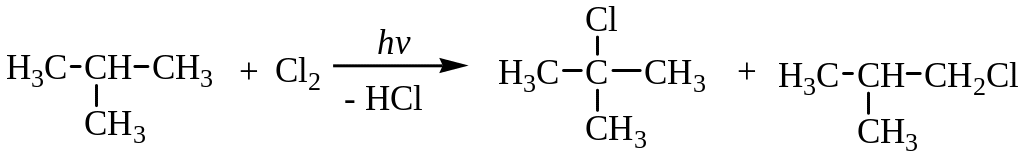
В процессе хлорирования изобутана на стадии роста цепи образуется два радикала - первичный и третичный:
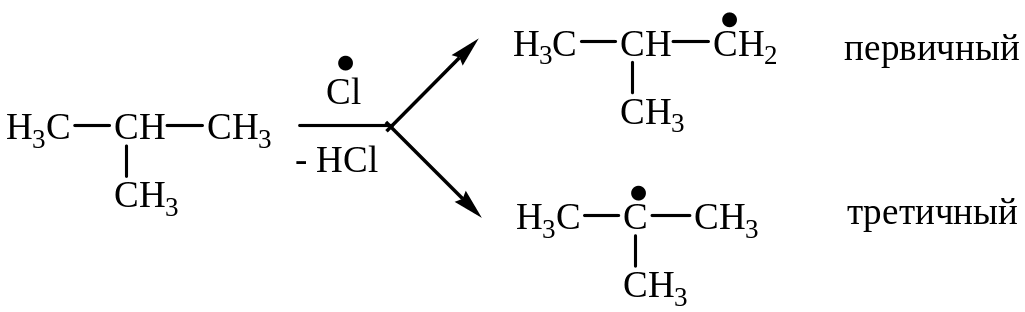
Более устойчивым радикалом является третичный, так как у него делокализация неспаренного электрона больше, чем у первичного, вследствие +I (индукционный эффект) и гиперконьюгационного эффекта:
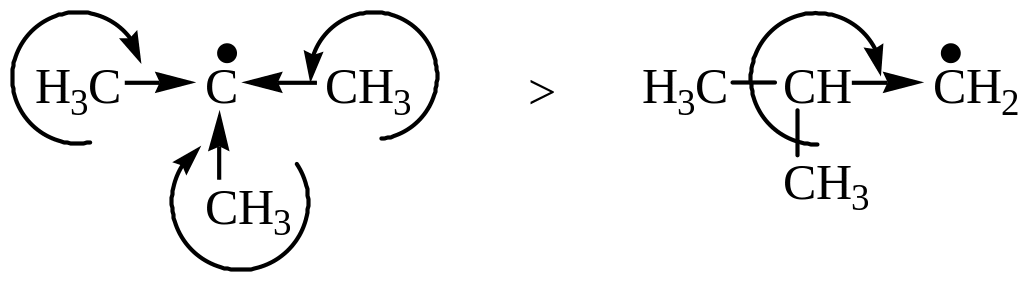
9 С-Н связей 1 С-Н связь
Устойчивость радикалов увеличивается в ряду
![]()
Различная устойчивость образующихся на стадии роста цепи алкильных радикалов определяет активность третичных, вторичных и первичных С-Н связей: наиболее активна третичная С-Н связь, затем вторичная и первичная.
Общие проблемы галогенирования алканов
Простейшая реакция взаимодействия метана с хлором приводит к образованию хлористого метила и хлористого водорода:
СН4 + Cl2 СН3Сl + НСl
Для того, чтобы определить практическое значение этой реакции, необходимо ответить на два вопроса:
о константах равновесия;
о скорости протекания данной реакции в данных условиях.
После того, как будет выяснено, что данная реакция должна протекать с удобной для нас скоростью, необходимо решить еще ряд практических вопросов: учесть побочные реакции, легкость выделения продуктов из реаакционной смеси и стоимость материалов, аппаратуры и труда, экологическую чистоту процесса.
Константа равновесия
Реакция метана и хлора - реакция равновесная:
![]()
Равновесие может быть описано следующим уравнением:
![]()
Величины, заключенные в квадратные скобки, означают либо концентрации (в случае жидких реагентов), либо парциальные давления для случая реагирующих газов. Если константа равновесия К больше единицы, то при смешении равных объемов реагентов (все они при температуре выше 24С являются газами) реакция будет проходить слева направо. И наоборот, при значениях К меньше единицы равновесие реакции смещено в сторону исходных реагентов. Для случая хлорирования метана К больше единицы (данные эксперимента).
С точки зрения планирования других органических синтезов чрезвычайно важно было бы иметь возможность предсказывать величину К заранее.
Точное термодинамическое соотношение между константой равновесия реакции К, температурой реакции и энтальпией реакции выражается следующим уравнением:
-2,303 RT lgK = Н - TS
где R - газовая постоянная, Т - абсолютная температура, К.
Зная значения Н и S, можно вычислить и константу равновесия одной реакции. Из опыта известно, что К обычно больше единицы для большинства реакций с Н, имеющей более отрицательное значение, чем -15 ккал, и обычно меньше единицы при Н, имеющей более положительное значение, чем +15 ккал. Это положение используется в качестве «правила большого пальца» для предсказания величины константы К.
Скорость реакции
Как правило, химические реакции протекают в несколько стадий, и для того, чтобы верно определить скорость определяющей стадии реакции, необходимо знать механизм реакции.
Суммарный процесс взаимодействия метана с хлором описывается следующим брутто - уравнением:
![]()
На самом деле реакция проходит через ряд стадий (табл. 2.1).
Таблица 2.1
Стадия |
Реакция |
Название стадий реакции |
А |
|
инициирование цепи |
Б |
|
рост цепи |
В |
|
|
Г |
|
обрыв цепи |
На каждой из стадий либо поглощается, либо выделяется энергия.
Стадия А: Н = +58 ккал/моль - тепло поглощается.
Стадия Б: Н = -1 ккал/моль - тепло выделяется.
Стадия В: Н = -23ккал/моль - тепло выделяется.
Стадия Г: Н = - 58 ккал/моль - тепло выделяется.
Суммарная энергия (теплота реакции) Нреакции = -24 ккал/моль.
Кравновесия = 1018.
В табл. 2.2 приведены теплоты реакции галогенирования по стадиям для F, Cl, Br, I.
Таблица 2.2
Стадия |
Реакция |
Теплота реакции, ккал/моль |
|||
F |
Cl |
Br |
I |
||
А |
|
+37 |
+58 |
+46 |
+36 |
Б |
|
-33 |
-1 |
+15 |
+31 |
В |
|
-71 |
-23 |
-21 |
-17 |
Г |
|
-37 |
-58 |
-46 |
-36 |
Нсумм |
-104 |
-24 |
-6 |
+14 |
|
Легкость взаимодействия галогенов с метаном (а следовательно, и скорость реакции) убывает в следующем ряду: F Cl Br I. Как видно из данных приведенной выше таблицы, относительные скорости согласуются с суммарными значениями Н всего процесса.
Энергетические профили для стадий роста цепи при хлорировании и бромировании имеют следующий вид:
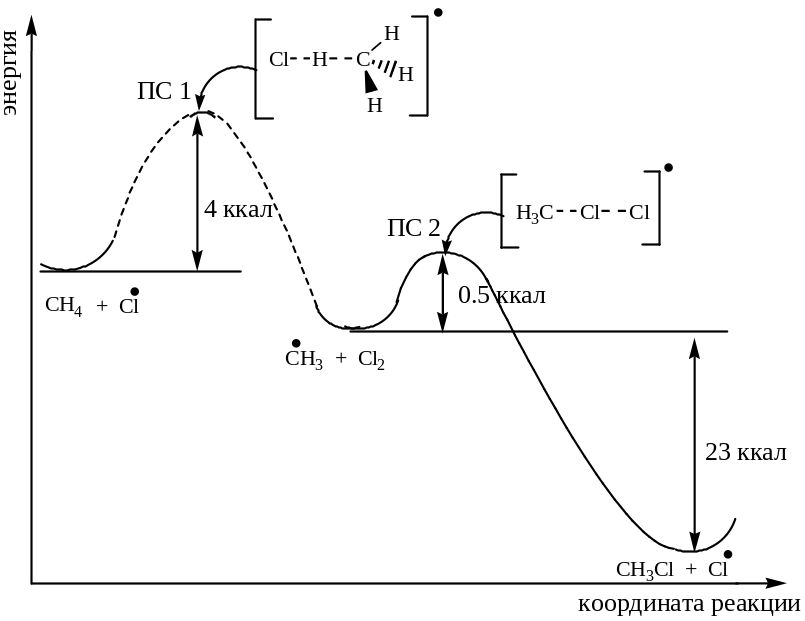
Переходное состояние (ПС) - максимум на энергетической диаграмме реакции. Группа атомов, участвующая в переходном состоянии, называется активированным комплексом.
В заключение можно сказать, что скорость галогенирования определяется скоростью первой стадии роста цепи, поскольку именно на этой стадии мы сталкиваемся с энергетическими барьерами (высокие значения Е), которые затрудняют бромирование и препятствуют иодированию.
Нитрование. Нитрование - реакция замещения атома водорода на нитрогруппу (NO2).
Нитрование может быть жидкофазным (М.И. Коновалов) и парофазным (Хесс, 1936-1937). В первом случае реакцию проводят с использованием 10 – 12% раствора азотной кислоты при 110 - 140С, во втором случае температуру повышают до 350 - 400С.
Общая схема реакции:
![]()
Свободнорадикальный механизм нитрования алканов:
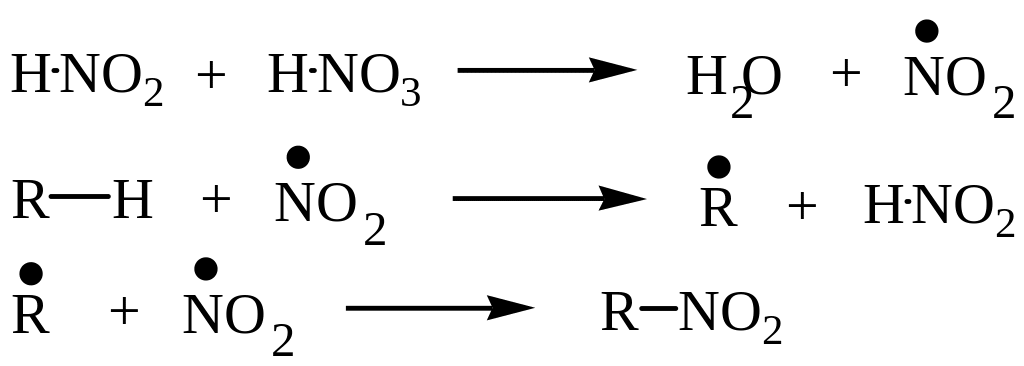
Состав продуктов нитрования, так же, как и в случае галогенирования, определяется относительной активностью различных С-Н связей.
Парофазное нитрование углеводородов, как, например, бутана, сопровождается расщеплением углеродной цепи:

3. Сульфохлорирование. Сульфохлорирование алканов протекает по цепному радикальному механизму при УФ – облучении:
![]()
Механизм реакции:
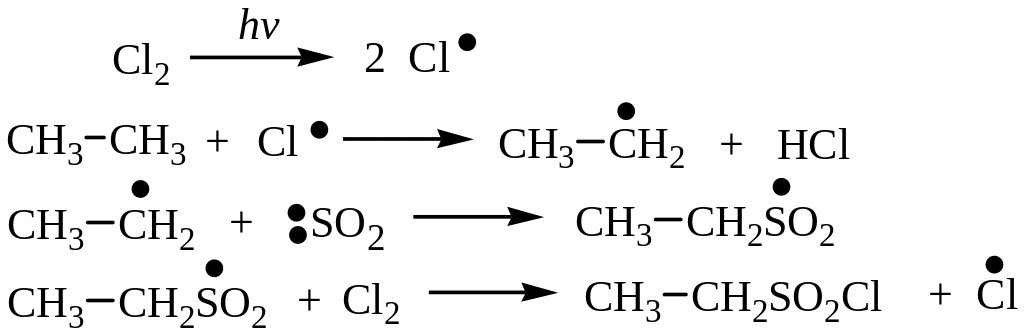
Обрыв цепи происходит при взаимодействии радикалов. Следует отметить, что третичный атом замещению на сульфохлоридную группу не подвергается, вероятно, из-за пространственных эффектов. Однако если в молекуле есть вторичные и первичные углеродные атомы, то замещение протекает в первую очередь у вторичного.