
- •Лабораторная работа № 8. Тема: Приготовление раствора точной заданной концентрации.
- •Перечень заданий:
- •1. Приготовление растворов различной концентрации в лабораторных условиях.
- •2. Решение типовых задач по различным методам объемного анализа.
- •Теоретические основы:
- •0,2 Н, 0,зн, 0,4н - децинормальная концентрация. 0,01 н, 0,02 н, 0,03 н, 0,04 н - сантинормальная концентрация.
- •Ход работы:
- •Задание 1.(10 баллов)
- •Алгоритм выполнения:
- •Задание 3.(5 баллов)
- •3. Как можно рассчитать нормальную концентрацию кислоты, щелочи и соли?
- •4. Какие требования предъявляются к титрованию?
- •5. Назовите растворы, которые являются рабочими в методах объемного анализа.
Лабораторная работа № 8. Тема: Приготовление раствора точной заданной концентрации.
Содержание типовой задачи деятельности:
Осуществление оперативного регулирования хода производства и обслуживания.
Умения: Используя рациональные способы ведения технологических процессов, учиться готовить растворы различной концентрации, уметь рассчитывать массу вещества, массу раствора, нормальность и титр.
ПФ. С. 17. ПП. Н. 03 ПФ - профессиональная задача;
С - класс задач (стереотипная);
ПП - вид умения (профессионально-предметный)
Н - уровень сформированности умения (умение выполнять действие автоматически).
Материально-техническое обеспечение:
Мерные колбы, титровальные колбы, пипетки Мора, химические реактивы, химические стаканы, воронки, технохимические весы, разновесы, мерный цилиндр.
Техника безопасности:
Во время работы в химической лаборатории необходимо соблюдать осторожность, поддерживать порядок и чистоту на рабочем месте. Не брать реактивы руками, а только металлической или фарфоровой ложечкой или шпателем. Нельзя взятый избыток реактива высыпать или выливать из своей пробирки в общую реактивную склянку. Ни в коем случае нельзя пробовать химические вещества на вкус.
Межпредметная связь:
Неорганическая химия, физическая и коллоидная химия, микробиология и физиология, технология приготовления пищи.
Критерии оценивания: Результат оценивания:
Задание № 1 – 10 баллов; 28 – 30 оценка «5»;
Задание № 2 – 15 баллов; 27 – 22 оценка «4»;
Задание № 3 – 5 баллов; 21 – 15 оценка «3»;
- 1 балл - защита с
нарушением графика;
- 1 балл небрежное
оформление отчёта.
Перечень заданий:
1. Приготовление растворов различной концентрации в лабораторных условиях.
2. Решение типовых задач по различным методам объемного анализа.
3. Вопросы для самоконтроля.
Теоретические основы:
В количественном анализе концентрацию растворов выражают нормальностью и титром (Н и Т).
Раствор называется нормальным, если в 1л его содержится 1 грамм-эквивалент растворённого вещества.
Различают растворы различной нормальности 1 Н, 2 Н, 3 Н, 4 Н и т.д. 0,1 Н,
0,2 Н, 0,зн, 0,4н - децинормальная концентрация. 0,01 н, 0,02 н, 0,03 н, 0,04 н - сантинормальная концентрация.
Титр показывает, сколько граммов вещества растворено в 1мл раствора. Между нормальностью и титром существует определенная связь. Так, например:
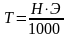 ;
;
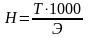 ,
,
где Т - титр;
Н - нормальная концентрация;
Э - эквивалент химического вещества.
Грамм-эквивалентом называют количество вещества, выраженное в граммах, которое при химических реакциях равноценно (эквивалентно) одному грамм-иону или (грамм-атому) водорода (1,008г). Обозначается условно буквой Э или г-экв.
При приготовлении рабочих титрованных растворов кислот, оснований и солей следует иметь в виду, что г-экв кислоты и основания будет равен ее грамм-молекулярному весу, деленному на основность. Например:
Э НСI= М НСI = 36,46 г-экв = 36,46
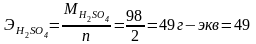 ;
;
 ;
;
Грамм-эквивалент соли в реакции полного объема равен ее грамм-молекулярно- му весу, деленному на суммарную валентность.
Например:
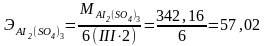 ;
;
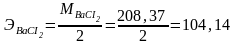 .
.
Необходимо твердо запомнить, что грамм-эквивалент не является величиной постоянной. В противоположность грамм-молекуле величина г-экв одного и того же вещества в различных реакциях может быть не одинакова. Исключение составляет определение величины г-экв окислителя и восстановителя. Этот вопрос будет рассмотрен в разделе оксидиметрии.
