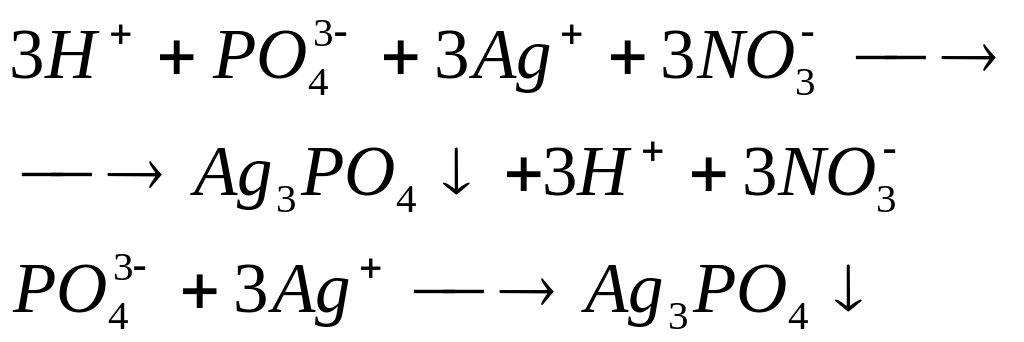Оксид фосфора (V)
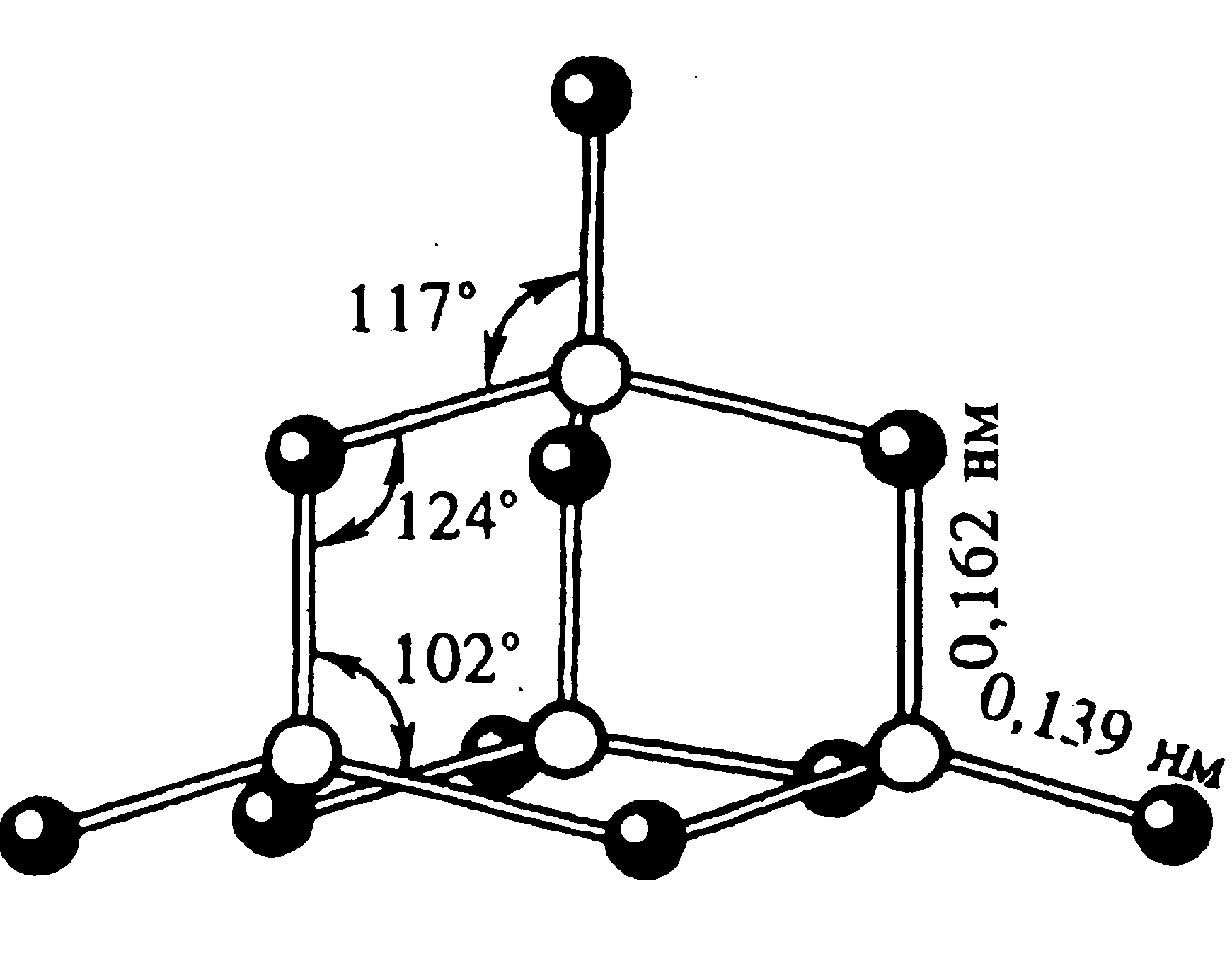
Фосфор образует несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10 (Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое расположение атомов фосфора. |
|
P2+5O5 Фосфорный ангидрид (оксид фосфора (V))
Белые кристаллы, t0пл.= 5700С, t0кип.= 6000C, = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO Ba3(PO4)2
В зависимости от избытка щелочи образует средние и кислые соли:
![]()
![]() гидрофосфат
натрия
гидрофосфат
натрия
![]() дигидрофосфат
натрия
дигидрофосфат
натрия
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратирующего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием ее ангидрида:
![]()
О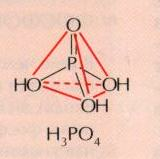 ртофосфорная
кислота.
Известно несколько кислот, содержащих
фосфор. Важнейшая из них — ортофосфорная
кислота Н3РО4
(Рис.5).
ртофосфорная
кислота.
Известно несколько кислот, содержащих
фосфор. Важнейшая из них — ортофосфорная
кислота Н3РО4
(Рис.5).
Безводная ортофосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,350С. С водой фосфорная кислота образует растворы любых концентраций.
Ортофосфорной кислоте соответствует следующая структурная формула:
Н
 О
ОН
О
ОН
Р
О ОН
В лаборатории ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
![]()
В промышленности ортофосфорную кислоту получают двумя способами: экстракционным и термическим.
1. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
![]()
Ортофосфорная кислота затем отфильтровывается и концентрируется упариванием.
2. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу ортофосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Физические свойства. Ортофосфорная кислота — твердое, бесцветное, кристаллическое вещество, хорошо растворимое в воде.
Химические свойства ортофосфорной кислоты представлены в табл.2:
Таблица 2
Химические свойства ортофосфорной кислоты
Общие с другими кислотами |
Специфические |
1. Водный раствор кислоты изменяет окраску индикаторов. Диссоциация происходит ступенчато:
Легче всего идет диссоциация по первой ступени и труднее всего – по третьей 2. Реагирует с металлами, расположенными в вытеснительном ряду до водорода:
3. Реагирует с основными оксидами:
4. Реагирует с основаниями и аммиаком; если кислота взята в избытке, то образуются кислые соли:
гидрофосфат натрия
дигидрофосфат натрия
5. Реагирует с солями слабых кислот:
|
двуфосфорная кислота
2. При действии раствора нитрата серебра (I) появляется желтый осадок:
желтый осадок
3. Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ. При разложении АТФ выделяется большое количество энергии.
|
Ортофосфаты. Ортофосфорная кислота образует три ряда солей. Если обозначить атомы металлов буквами Me, то можно изобразить в общем виде состав ее солей (табл.3).
Таблица 3
Химические формулы ортофосфатов, содержащих металлы
одновалентные |
двухвалентные |
трехвалентные |
Ме3РО4
|
Ортофосфаты Ме3(РО4)2 |
Ме3РО4 |
Ме2НРО4 |
Гидроортофосфаты МеНРО4
|
Ме2(НРО4)3 |
МеН2РО4 |
Дигидроортофосфаты Ме(Н2РО4)2 |
Ме(Н2РО4)3 |
Вместо одновалентного металла в состав молекул ортофосфатов может входить группа аммония: (NH4)3PO4 - ортофосфат аммония;
(NH4)2HPO4—гидроортофосфат аммония; NH4H2PO4 – дигидро-ортофосфат аммония.
Ортофосфаты и гидроортофосфаты кальция и аммония широко используют в качестве удобрений, ортофосфат и гидроортофосфат натрия — для осаждения из воды солей кальция.