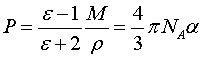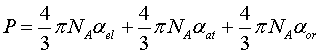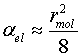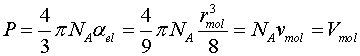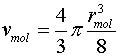- •13. А) Система –Химические системы
- •Принцип ле-шателье.Смещение химического равновесия.
- •Твёрдые, жидкие, газообразные растворы
- •[Править]Ионные и коллоидные растворы
- •[Править]Растворение
- •[Править]Растворы электролитов и неэлектролитов
- •[Править]Растворы полимеров
- •[Править]Окисление
- •[Править]Восстановление
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •27. А) Электролиз
- •1. Покрытие металлов слоем другого металла при помощи электролиза (гальваностегия).
- •3. Рафинирование (очистка) металлов.
Основные понятия химии. Стехиометрия
1. а) Химический элемент - это вид атомов с определенным зарядом ядер и строением электронной оболочки.
б) Атом – наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженныхпротонов и незаряженных нейтронов.
в) Молекула - Молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов.
г) Простое вещество – это вещество, которое состоит из атомов только одного элемента или из молекул, построенных из атомов одного элемента. Примеры: железо (Fe), кислород (O2), медь (Cu)и т.д.
д) Сложное вещество – это вещество, которое состоит из молекул, построенных из атомов разных элементов. Примеры: H2O , бензин ( смесь углеводорода), сахар (C12H22O11)
е) Относительная атомная масса – Относительная атомная масса элемента - это число, показывающее, во сколько раз масса одного атома данного элемента больше 1/12 части массы атома изотопа углерода-12 (12С)
ж) Относительная молекулярная масса – или сокращенно молекулярная масса - это единица количества вещества в химии. Относительной молекулярной массой (сокращенно - молекулярной массой) вещества называют отношение массы его молекулы к 1/12 части массы изотопа углерода 12С. Поскольку масса любой молекулы равна сумме масс составляющих ее атомов, то относительная молекулярная масса равна сумме соответствующих относительных атомных масс. Масса вещества в граммах, численно равная его относительной молекулярной массе называется молем, обозначение - моль. Масса вещества в килограммах, численно равная его относительной молекулярной массе называется киломолем, обозначение - кмоль. Относительной атомной массой (сокращенно - атомная масса) элемента называют отношение массы его атома к 1/12 части массы изотопа углерода 12С. Например, молекулярная масса воды, молекула которой содержит два атома водорода, равна: 1,0079·2 + 15,994 = 18,0152 (в современной шкале относительные атомные массы кислорода и водорода равны соответственно 15,9994 и 1,00794).
з) Кол-во вещества – это физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
и) Постоянная Авагадро – это физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электроновили любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, реже как L [1].
NA = 6,02214129(27)×1023 моль−1.
к) Молярная масса – это масса, которую имеет 1 моль данного вещества. Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
л) Молярный объем – это Молярный объем вещества — есть отношение объема, занимаемого веществом, к его количеству. Нетрудно рассчитать, какой объем занимает один моль газа при нормальных условиях, то есть при нормальном атмосферном давлении (101.325кПа или 760 мм рт. ст.) и температуре 0 ºС. Например, экспериментально установлено, что масса 1 литра кислорода при нормальных условиях равна 1.43 грамм. Следовательно, объем, занимаемый при тех же условиях одним молем кислорода (32 грамма), составит 32:1.43 = 22.4 литра. То же число получим, рассчитав объем одного моля водорода, диоксида углерода и т.д.
Как следует из изложенного, при нормальных условиях молярный объем любого газа равен 22.4 л/моль.
2. а) Закон постоянства состава – Все индивидуальные вещества имеют постоянный качественный и количественный состав независимо от способа их получения.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Б) Закон сохранения массы – Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ.
Например, реакция горения метана записывается следующим образом:
![]()
На основании химических уравнений проводятся стехиометрические расчеты.
В) Закон кратных отношений – Кратных отношений закон закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Г) Закон объемных отношений – бъемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Примеры.
a)
2CO + O2 = 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
Д) Уравнение Менделеева – Клапейрона- Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атм и температуре 26 оС. Вопрос: сколько молей O2содержится в колбе?
Из газового закона найдем искомое число молей n:

Е) Уравнение эквивалентов - Эквивалентом вещества считается такое его количество, которое соединяется с одним молем атомов Н2 или замещает то же количество атомов Н2 в хим. реакциях. Эквивалентной же массой считают массу одного эквивалента вещества. При вычисления эквивалента (или эквивалентной массы) элемента можно не исходить из его соединения с Н2. Эквивалент (эквивалентную массу) легко определить по составу соединения данного элемента с каким либо другим, эквивалент которого считается известным.
Их законов эквивалентов вытекают выражения , по которым можно определить эквивалентные массы сложных веществ:
Э оксида = М оксида / (Число атомов элемента х валентность элемента)
Э кислоты = М кислоты / Основность кислоты
Э основания = М основания / Кислотность основания
Где М - мольная масса соединений
3. а) Эквивалент химического элемента – это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентнакатиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции: NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+
Б) Эквивалент сложного вещества – сложного вещества называют такое количество его, которое взаимодействует без остатка с 1 эквивалентом водорода или с 1 эквивалентом любого другого вещества.
В) Эквивалентная масса – это масса 1 эквивалента элемента. Эквивалентные массы обычно определяются либо по данным анализа соединений, либо на основании результатов замещения одного элемента другим. Нетрудно понять, что для определения эквивалента (или эквивалентной массы) элемента вовсе необязательно исходить из его соединения с водородом. Эквивалент (эквивалентную массу) можно точно так же вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известен.
Пример. При соединении 1,50 грамма натрия с избытком хлора образовалось 3,81 грамма хлорида натрия. Необходимо найти эквивалентную массу натрия и его эквивалент, если известно, что эквивалентная масса хлора равна 35,45 грамм/моль.
Решение. Вычитайте из общей массы образовавшегося продукта исходную массу натрия. Таким образом, 3, 81 – 1, 50 = 2, 31
То есть, в образовавшемся продукте (в вашем случае хлорид натрия) на 1,50 грамма натрия приходится 2,31 грамма хлора. Из этого следует, что зная эквивалентную массу хлора (35, 45 грамм/моль), вы легко найдете эквивалентную массу натрия по следующей формуле: 35, 45 х 1, 50 / 2, 31
Эквивалентная масса натрия получается равной 23,0 грамм/моль.
Г) Эквивалентный объем – объем, который занимает при данных условиях 1 эквивалент рассматриваемого вещества. Например, при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, эквивалентный объем кислорода —5,6 л/моль.
Д) Вычисление эквивалентных масс сложных веществ - ??????
Строение атома и периодический закон.
4. а) Основные представления квантовой механики – раздел теоретической физики, описывающий квантовые системы и законы их движения.
Классическая механика, хорошо описывающая системы макроскопических масштабов, не способна описать явления на уровне атомов, молекул, электронов и фотонов. Квантовая механика адекватно описывает основные свойства и поведение атомов, ионов, молекул,конденсированных сред, и других систем с электронно-ядерным строением. Квантовая механика также способна описывать поведение электронов, фотонов, а также других элементарных частиц, если пренебречь взаимопревращением элементарных частиц. Описание превращений элементарных частиц строится в рамках квантовой теории поля. Эксперименты подтверждают результаты, полученные с помощью квантовой механики.
Основными понятиями квантовой кинематики являются понятия наблюдаемой и состояния.
Основные уравнения квантовой динамики — уравнение Шрёдингера, уравнение фон Неймана, уравнение Линдблада, уравнение Гейзенберга и уравнение Паули
Уравнения квантовой механики тесно связаны со многими разделами математики, среди которых: теория операторов, теория вероятностей, функциональный анализ, операторные алгебры, теория групп.
б)
Уравнение Шредингера
– Пусть ![]() амплитуда
вероятности нахождения
частицы в точке М.
Стационарное уравнение Шрёдингера
позволяет ее определить.
Функция
удовлетворяет
уравнению:
амплитуда
вероятности нахождения
частицы в точке М.
Стационарное уравнение Шрёдингера
позволяет ее определить.
Функция
удовлетворяет
уравнению:
![]()
где ![]() —оператор
Лапласа,
а
—оператор
Лапласа,
а ![]() — потенциальная
энергия частицы
как функция
— потенциальная
энергия частицы
как функция ![]() .
.
Решение стационарного уравнения
Пусть E и U две постоянные, независимые от . Записав стационарное уравнение как:
![]()
Если E - U > 0, то:
![]()
![]()
Решение стационарного уравнения в случае, когда E-U>0
![]()
где: ![]() —
модуль волнового
вектора;
A и B — две постоянные, определяющиеся граничными
условиями.
—
модуль волнового
вектора;
A и B — две постоянные, определяющиеся граничными
условиями.
Если E - U < 0, то:
![]()
где: ![]() —
модуль волнового
вектора;
C и D — две постоянные, также
определяющиеся граничными
условиями.
—
модуль волнового
вектора;
C и D — две постоянные, также
определяющиеся граничными
условиями.
в)
Волновая функция
– Волновая
функция (или
вектор состояния) – комплексная функция,
описывающая состояние квантовомеханической
системы. Её знание позволяет получить
максимально полные сведения о системе,
принципиально достижимые в микромире.
Так с её помощью можно рассчитать все
измеряемые физические характеристики
системы, вероятность пребывания её в
определенном месте пространства и
эволюцию во времени. Волновая функция
может быть найдена в результате решения
волнового уравнения Шредингера.
Волновая функция ψ(x, y, z, t) ≡
ψ(x,t) точечной
бесструктурной частицы является
комплексной функцией координат этой
частицы и времени. Простейшим примером
такой функции является волновая функция
свободной частицы с импульсом ![]() и
полной энергией Е (плоская волна)
и
полной энергией Е (плоская волна)
 .
.
Волновая
функция системы А частиц содержит
координаты всех частиц: ψ(![]() 1,
2,...,
A,t).
Квадрат модуля волновой функции отдельной
частицы |ψ(
,t)|2 = ψ*(
,t)ψ(
,t) дает
вероятность обнаружить частицу в момент
времени t в точке пространства, описываемой
координатами
,
а именно, |ψ(
,t)|2dv ≡ |ψ(x,
y, z, t)|2dxdydz это
вероятность найти частицу в области
пространства объемом dv = dxdydz вокруг
точки x, y, z. Аналогично, вероятность
найти в момент времени t систему А частиц
с координатами
1,
2,...,
A в
элементе объема многомерного пространства
дается величиной|ψ(
1,
2,...,
A,t)|2dv1dv2...dvA.
Волновая функция полностью определяет
все физические характеристики квантовой
системы. Так среднее наблюдаемое значение
физической величины F у системы дается
выражением
1,
2,...,
A,t).
Квадрат модуля волновой функции отдельной
частицы |ψ(
,t)|2 = ψ*(
,t)ψ(
,t) дает
вероятность обнаружить частицу в момент
времени t в точке пространства, описываемой
координатами
,
а именно, |ψ(
,t)|2dv ≡ |ψ(x,
y, z, t)|2dxdydz это
вероятность найти частицу в области
пространства объемом dv = dxdydz вокруг
точки x, y, z. Аналогично, вероятность
найти в момент времени t систему А частиц
с координатами
1,
2,...,
A в
элементе объема многомерного пространства
дается величиной|ψ(
1,
2,...,
A,t)|2dv1dv2...dvA.
Волновая функция полностью определяет
все физические характеристики квантовой
системы. Так среднее наблюдаемое значение
физической величины F у системы дается
выражением
![]() ,
,
где ![]() -
оператор этой величины и интегрирование
проводится по всей области многомерного
пространства.
В качестве
независимых переменных волновой функции
вместо координат частиц x, y, z могут быть
выбраны их импульсы px,
py,
pz или
другие наборы физических величин. Этот
выбор зависит от представления
(координатного, импульсного или
другого).
Волновая функция
ψ(
,t) частицы
не учитывает ее внутренних характеристик
и степеней свободы, т. е. описывает ее
движение как целого бесструктурного
(точечного) объекта по некой траектории
(орбите) в пространстве. Этими внутренними
характеристиками частицы могут быть
её спин, спиральность, изоспин (для
сильновзаимодействующих частиц), цвет
(для кварков и глюонов) и некоторые
другие. Внутренние характеристики
частицы задаются специальной волновой
функцией её внутреннего состояния φ.
При этом полная волновая функция частицы
Ψ может быть представлена в виде
произведения функции орбитального
движения ψ и внутренней функции φ:
-
оператор этой величины и интегрирование
проводится по всей области многомерного
пространства.
В качестве
независимых переменных волновой функции
вместо координат частиц x, y, z могут быть
выбраны их импульсы px,
py,
pz или
другие наборы физических величин. Этот
выбор зависит от представления
(координатного, импульсного или
другого).
Волновая функция
ψ(
,t) частицы
не учитывает ее внутренних характеристик
и степеней свободы, т. е. описывает ее
движение как целого бесструктурного
(точечного) объекта по некой траектории
(орбите) в пространстве. Этими внутренними
характеристиками частицы могут быть
её спин, спиральность, изоспин (для
сильновзаимодействующих частиц), цвет
(для кварков и глюонов) и некоторые
другие. Внутренние характеристики
частицы задаются специальной волновой
функцией её внутреннего состояния φ.
При этом полная волновая функция частицы
Ψ может быть представлена в виде
произведения функции орбитального
движения ψ и внутренней функции φ:
Ψ = φψ,
поскольку
обычно внутренние характеристики
частицы и её степени свободы, описывающие
орбитальное движение, не зависят друг
от друга.
В качестве
примера ограничимся случаем, когда
единственной внутренней характеристикой,
учитываемой функцией ![]() ,
является спин частицы, причем этот спин
равен 1/2. Частица с таким спином может
пребывать в одном из двух состояний - с
проекцией спина на ось z, равной +1/2 (спин
вверх), и с проекцией спина на ось z,
равной -1/2 (спин вниз). Эту двойственность
описывают спиновой функцией
,
является спин частицы, причем этот спин
равен 1/2. Частица с таким спином может
пребывать в одном из двух состояний - с
проекцией спина на ось z, равной +1/2 (спин
вверх), и с проекцией спина на ось z,
равной -1/2 (спин вниз). Эту двойственность
описывают спиновой функцией ![]() взятой
в виде двухкомпонентного спинора:
взятой
в виде двухкомпонентного спинора:
![]()
![]()
Тогда волновая функция Ψ+1/2 = χ+1/2ψ будет описывать движение частицы со спином 1/2, направленным вверх, по траектории, определяемой функцией ψ , а волновая функцияΨ-1/2 = χ-1/2ψ будет описывать движение по той же траектории этой же частицы, но со спином, направленным вниз. В заключении отметим, что в квантовой механике возможны такие состояния, которые нельзя описать с помощью волновой функции. Такие состояния называют смешанными и их описывают в рамках более сложного подхода, использующего понятие матрицы плотности. Состояния квантовой системы, описываемые волновой функцией, называют чистыми.
г) Современная модель строения атома – В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv,
где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
д)
Массовое число
– Массовое
число –
суммарное число протонов и нейтронов
в атомном ядре. Как известно атомное
ядро состоит из протонов и нейтронов -
элементарных частиц, имеющих очень
близкие массы (![]() 1.67·10-24 г) и
объединяемых термином “нуклоны”. Если
число протонов в ядре обозначить буквой
Z, а число нейтронов - буквой N, то массовое
число (или число нуклонов) А = Z + N.
Термин “массовое число” связан с тем,
что именно количество нуклонов (протонов
и нейтронов) в ядре практически полностью
(с точностью обычно не хуже 1%) определяет
массу атомного ядра и атома. Знание
массового числа позволяет оценить массу
ядра и атома. Если известно массовое
число, то масса М атома и его ядра
оценивается из следующего
соотношения М
А·mN, где
mN -
масса нуклона, т.е. протона или нейтрона.
Например, в состав атома алюминия и его
ядра входит 27 нуклонов (13 протонов и
14 нейтронов). Его
масса
27·1.67·10-24 г
4.5·10-23 г. Если
необходимо получить массу ядра с большей
точностью, то нужно учесть, что нуклоны
в ядре связаны силами ядерного притяжения,
и поэтому в соответствии с соотношением
E = mc2 масса
ядра уменьшается. В массу атома также
следует добавить суммарную массу
электронов на орбитах вокруг ядра.
Однако все эти поправки не превышают
1%.
1.67·10-24 г) и
объединяемых термином “нуклоны”. Если
число протонов в ядре обозначить буквой
Z, а число нейтронов - буквой N, то массовое
число (или число нуклонов) А = Z + N.
Термин “массовое число” связан с тем,
что именно количество нуклонов (протонов
и нейтронов) в ядре практически полностью
(с точностью обычно не хуже 1%) определяет
массу атомного ядра и атома. Знание
массового числа позволяет оценить массу
ядра и атома. Если известно массовое
число, то масса М атома и его ядра
оценивается из следующего
соотношения М
А·mN, где
mN -
масса нуклона, т.е. протона или нейтрона.
Например, в состав атома алюминия и его
ядра входит 27 нуклонов (13 протонов и
14 нейтронов). Его
масса
27·1.67·10-24 г
4.5·10-23 г. Если
необходимо получить массу ядра с большей
точностью, то нужно учесть, что нуклоны
в ядре связаны силами ядерного притяжения,
и поэтому в соответствии с соотношением
E = mc2 масса
ядра уменьшается. В массу атома также
следует добавить суммарную массу
электронов на орбитах вокруг ядра.
Однако все эти поправки не превышают
1%.
е) Дефект массы – разность между массой покоя атомного ядра данного изотопа, выраженной в атомных единицах массы, имассовым числом данного изотопа. В современной науке для обозначения этой разницы пользуются термином избыток массы(англ. mass excess). Как правило, избыток массы выражается в кэВ.
![]()
Зарубежная номенклатура:
Дефе́кт
ма́ссы (англ. mass
defect)
— разность между суммой масс
покоя нуклонов,
составляющих ядро данного нуклида,
и массой
покоя атомного
ядра этого
нуклида, выраженная в атомных
единицах массы.
Обозначается обычно ![]() .
.
![]()
Согласно соотношению Эйнштейна дефект массы и энергия связи нуклонов в ядре эквивалентны:
![]()
где Δm — дефект массы и с — скорость света в вакууме.
ж) Изотопы – Изотопы (от изо... и греч. tópos - место), разновидности одного химического элемента, занимающие одно место в периодической системе элементов Менделеева, но отличающиеся массами атомов. Химические свойства атомов, т. е. принадлежность атома к тому или иному химическому элементу, зависят от числа электронов и их расположения в электронной оболочке атома (см. Атом). Место химического элемента в периодической системе элементов определяется его порядковым номером Z, равным числу электронов в оболочке атома или, что то же самое, числупротонов, содержащихся в атомном ядре. Кроме протонов, в ядро атома входят нейтроны, масса каждого из которых приблизительно равна массе протона. Количество нейтронов N в ядре атома с данным Z может быть различным, но в определённых пределах. Например, в ядре атома гелия (Z = 2) может содержаться 1, 2, 4 или 6 нейтронов. Полное число протонов Z и нейтронов N в ядре (называется общим термином нуклоны) определяет массу ядра и по существу массу всего атома. Это число А = Z + N называется массовым числом атома. От соотношения чисел протонов и нейтронов в ядре зависят стабильность или нестабильность ядра, тип распада радиоактивного ядра, спин, магнитный дипольный момент, электрический квадрупольный момент ядра и некоторые другие его свойства (см.Ядро атомное). Таким образом, атомы с одинаковым Z, но с различным числом нейтронов N обладают идентичными химическими свойствами, но имеют различные массы и различные ядерные свойства. Эти разновидности атомов также называются И. Для обозначения любых разновидностей атомов, независимо от их принадлежности к одному элементу, применяют термин нуклиды.
з)
Изобары -
нуклиды разных
элементов, имеющие одинаковое массовое
число;
например, изобарами являются 40Ar, 40K, 40Ca.
Хотя массовое число (т. е.
число нуклонов) A = N + Z в
ядрах-изобарах одинаково,
числа протонов Z и нейтронов N различаются: ![]() ,
, ![]() .
Совокупность изотопов с одинаковым A,
но разным Z называют
изобарической цепочкой. В то время как
массовое число изобаров одинаково,
ихатомные
массы совпадают
лишь приближённо. Зависимость атомной
массы (или избытка
массы)
от Z в
изобарической цепочке показывает
направление возможных бета-распадов.
Эта зависимость в первом приближении
представляет собой параболу (см. формула
Вайцзеккера) —
сечение долины
стабильности плоскостью A = const.
.
Совокупность изотопов с одинаковым A,
но разным Z называют
изобарической цепочкой. В то время как
массовое число изобаров одинаково,
ихатомные
массы совпадают
лишь приближённо. Зависимость атомной
массы (или избытка
массы)
от Z в
изобарической цепочке показывает
направление возможных бета-распадов.
Эта зависимость в первом приближении
представляет собой параболу (см. формула
Вайцзеккера) —
сечение долины
стабильности плоскостью A = const.
5. а) Атомные орбитали – Атомная орбиталь (АО) – область пространства вокруг ядра атома, в которой вероятность пребывания электрона достаточно высока (90%). Понятие «атомная орбиталь» связывает представления Бора об орбитах – траекториях с современными квантово – механическими представлениями о вероятностном характере движения электрона в атоме. Атомную орбиталь иногда рассматривают как электронное облако, представляющее собой наглядное изображение электрона, делокализованного в объеме атома. Атомные орбитали отличаются друг от друга размерами, формой, ориентацией в пространстве. Существуют следующие формы атомных атомных орбиталей:
![]()
Сферическая S – орбиталь.
![]()
Гантелеобразная p – орбиталь.
![]()
Четырехлопастная f – орбиталь.
Электрон имеет собственный магнитный и механический моменты, которые объединили общим названием «спин». Спин электрона не зависит от внешних условий и не связан с движением электрона в трехмерном пространстве, спин не может быть уничтожен или изменен.
На каждой атомной орбитали может одновременно находиться не больше 2 электронов. Если на одной орбитали находятся 2 электрона, то у них разный спин.
б) Квантовые числа – Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
![]()
Энергия для n = ∞ соответствует энергии одноэлектронной ионизации для данного энергетического уровня.
Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n — 1 (l = 0,1, …, n — 1).Момент импульса при этом задаётся соотношением
![]()
Атомные орбитали принято называть по буквенному обозначению их орбитального числа:
-
Значение орбитального квантового числа
0
1
2
3
4
Буквенное обозначение
s
p
d
f
g
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
Магнитное квантовое число ml определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -lдо l, включая 0 (ml = -l … 0 … l):
![]()
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу ниже) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy,4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
в) Принцип Паули – Принцип Паули является следствием свойства симметрии волновой функции тождественных фермионов. Частицы с полуцелым спином - фермионы (электроны, кварки, протоны, нейтроны, ядра с нечетным числом нуклонов) - подчиняются статистике Ферми-Дирака. Поэтому для тождественных фермионов волновая функция должна быть антисимметрична относительно их перестановки
ψ(2,1,..., A) = -ψ(1,2,..., A). |
(1) |
Если частицы 1 и 2 находятся в одинаковом состоянии, то ψ(2,1,..., A) = ψ(1,2,..., A), что противоречит (1) и возможно только в случае, если ψ(2,1,..., A) = ψ(1,2,..., A) ≡ 0. То есть в системах, подчиняющихся статистике Ферми-Дирака и описываемых антисимметричными волновыми функциями, не должно существовать двух тождественных частиц с полностью совпадающими квантовыми характеристиками. Это утверждение впервые было сформулировано В. Паули и называется принципом Паули.
г) Потенциал ионизации – Что называется энергией ионизации? Энергия ионизации элемента — энергия, необходимая для превращения 1 моля атомов в газовой фазе в 1 моль катионов в газовой фазе таким образом, чтобы от каждого атома отрывался один электрон. А(r)®А+(r)+ё- Энергию ионизации можно определить путем бомбардировки атомов электронами, ускоренными в электрическом поле. То наименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов, называется потенциалом ионизации атомов данного элемента и выражается в электронвольтах. При затрате достаточной энергии можно оторвать от атома два, три и более электронов. Поэтому говорят о первом потенциале ионизации (энергия отрыва от атома первого электрона), втором потенциале ионизации (энергия отрыва второго электрона) и т. д. По мере последовательного удаления электронов от атомов положительный заряд образующегося иона возрастает. Поэтому для отрыва каждого следующего электрона требуется большая затрата энергии, — иначе говоря, последовательные потенциалы ионизации атомов возрастают. Данные таблицы 1 показывают, что от атома лития сравнительно легко отрывается один электрон, от атома бериллия — два, от атома бора — три, от атома углерода — четыре. Отрыв же последующих электронов требует гораздо большей затраты энергии. Это соответствует нашим представлениям о строении рассматриваемых атомов. Действительно, у атома лития во внешнем электронном слое размещается один электрон, а у атома бериллия — 2, бора — 3, углерода — 4. Эти электроны обладают более высокой энергией, чем электроны предшествующего слоя, и поэтому их отрыв от атома требует сравнительно небольших энергетических затрат. При переходе же к следующему электронному слою энергия ионизации резко возрастает. Величина потенциала ионизации может служить мерой большей или меньшей «металличности» элемента: чем меньше потенциал ионизации, тем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента.
Таблица 1. Последовательные потенциалы ионизации атомов некоторых элементов второго периода

Рассмотрим с этой точки зрения, как изменяются первые потенциалы с увеличением атомного номера у атомов одной и той же подгруппы периодической системы (табл. 2). Как видно, с увеличением порядкового номера элемента потенциалы ионизации уменьшаются, что свидетельствует об усилении металлических и, соответственно, ослаблении неметаллических свойств. Эта закономерность связана с возрастанием радиусов атомов. Кроме этого, увеличение числа промежуточных электронных слоев, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшению потенциала ионизации. У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается.
д) Сродство к электрону – Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
6. а) Периодический закон и система хим. Элементов - Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно.
В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F - у элементов хлор Cl, бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия - галлия Ga, аналога кремния - германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. |
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов.
б) Строение электронных оболочек атома - область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяетсяПравилом Хунда. Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
в) Правило Хунда - 1. Правило Хунда. При уменьшении расстояния между электронами энергия их электростатического отталкивания растет. Потому электроны одной оболочки одного атома заполняют такие квантовые состояния, при которых перекрытие их волновых функций, а значит, суммарная энергия взаимодействия, минимальны. Для этого проекции спинового числа электронов на направление движения должны быть параллельными, а значит, согласно принципу Паули, двухэлектронная волновая функция должна быть антисимметричной относительно перестановок в пространстве. А это, в свою очередь, означает то, что два электрона с параллельными спинами заполняют разные орбитали одной оболочки. При этом, конечно, суммарное спиновое число системы электронов максимально. Такому состоянию соответствует положительный знак обменной энергии взаимодействия двух электронов. Это значит, что при параллельной ориентации спинов потенциальная энергия взаимодействия электронов уменьшается. В этом суть правила Хунда. 2. Ферромагнетизм. Ферромагнетизм соответствует параллельной ориентации спинов (а значит, и магнитных моментов) электронов разных атомов. Такое состояние в ферромагнетиках соответствует минимуму энергии подобно тому, как в изолированном атоме минимуму соответствует параллельная ориентация спинов электронов на разных орбиталях одной оболочки. Параллельность спинов неспаренных электронов разных атомов ферромагнетика обусловливается положительным знаком обменной энергии. Знак обменной энергии соответствует знаку обменного интеграла. Знак обменного интеграла для кристалла зависит от величины а/д, где а - постоянная данной кристаллической решетки и д - характерный радиус орбитали, на которой находится электрон. Для ферромагнетиков а/д>1,5, и в результате этого обменный интеграл положительный. При этом, член спиновой части в выражении для обменной энергии должен соответствовать параллельным спинам. Это значит, что значения параметров а и д в ферромагнетиках таковы, что эффект расталкивания электронов, а значит, минимизации их электростатического взаимодействия, есть основополагающим для их энергии взаимодействия.
г) Правило Клечевского - мпирическое правило, описывающее энергетическое распределениеорбиталей в многоэлектронных атомах.
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением 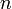 .
.
орбитальная
энергия последовательно повышается по
мере увеличения суммы
,
причём при одном и том же значении этой
суммы относительно меньшей энергией
обладает атомная орбиталь с меньшим
значением главного квантового
числа
. Например,
при ![]() орбитальные
энергии подчиняются последовательности
орбитальные
энергии подчиняются последовательности ![]() ,
так как здесь для
,
так как здесь для ![]() -орбитали
главное квантовое число наименьшее
-орбитали
главное квантовое число наименьшее ![]() ,
для
,
для ![]() -орбитали
-орбитали ![]() ;
наибольшее
,
;
наибольшее
, ![]() -орбиталь
занимает промежуточное положение
-орбиталь
занимает промежуточное положение ![]() .
.
Или же:
При
заполнении орбитальных оболочек атома
более предпочтительны (более энергетически
выгодны), и, значит, заполняются раньше
те состояния, для которых сумма главного
квантового числа
и
побочного (орбитального) квантового
числа ![]() ,
т.е.
,
имеет меньшее значение.
,
т.е.
,
имеет меньшее значение.
Правило (n+l) в целом хорошо иллюстрирует таблица 1, где по мере постепенного возрастания суммы (n+l) приведена энергетическая последовательность атомных орбиталей. В этой таблице не указаны нереальные (запрещенные квантовой механикой атома) варианты, для которых не выполняется обязательное требование n>l, в частности не указаны комбинации для (n+l)=6:
7. а) Радиоактивность – Радиоактивность – самопроизвольные превращения атомных ядер, сопровождающиеся испусканием элементарных частиц или более лёгких ядер. Ядра, подверженные таким превращениям, называют радиоактивными, а процесс превращения – радиоактивным распадом. Радиоактивный распад возможен только тогда, когда он энергетически выгоден, т.е. сопровождается выделением энергии. Условием этого является превышение массы М исходного ядра суммы масс mi продуктов распада, т.е. неравенство
![]() .
.
Б) Постоянная радиоактивного распада – Постоянная радиоактивного распада (λ) — вероятность распада каждого отдельного ядра атома за единицу времени, измеряемая в единицах, обратных единицам измерения времени (сек-1, мин-1). Для характеристики скорости распада (см. Радиоактивность) используют также период полураспада (Т) и среднее время жизни (т), которые связаны с П. р. р. следующими соотношениями: Для каждого радиоактивного изотопа λ имеет определенное значение и изменяется в широких пределах. Так, постоянная радиоактивного распада урана U234 равна 8,80·10-14 сек-1, фосфора Р32 —5,73·10-7 сек-1, полония Ро214 — 4,38·103 сек-1
В) Период полураспада – Пери́од полураспа́да квантовомеханической системы (частицы, ядра, атома, энергетического уровня и т. д.) — время T½, в течение которого система распадается с вероятностью 1/2. Если рассматривается ансамбль независимых частиц, то в течение одного периода полураспада количество выживших частиц уменьшится в среднем в 2 раза. Термин применим только к экспоненциально распадающимся системам.
Не следует считать, что за два периода полураспада распадутся все частицы, взятые в начальный момент. Поскольку каждый период полураспада уменьшает число выживших частиц вдвое, за время 2T½ останется четверть от начального числа частиц, за 3T½ — одна восьмая и т. д. Вообще, доля выживших частиц (или, точнее, вероятность выживания p для данной частицы) зависит от времени t следующим образом:
![]() .
.
Период полураспада, среднее время жизни τ и константа распада λ связаны следующими соотношениями, полученными из закона радиоактивного распада:
![]() .
.
Поскольку ln2 = 0,693… , период полураспада примерно на 30 % короче, чем среднее время жизни.
Иногда период полураспада называют также полупериодом распада.
На практике период полураспада определяют, измеряя активность исследуемого препарата через определенные промежутки времени. Учитывая, что активность препарата пропорциональна количеству атомов распадающегося вещества, и воспользовавшись законом радиоактивного распада, можно вычислить период полураспада данного вещества[1].
Г) Виды радиоактивного распада - Явление радиоактивности сопровождается превращением ядра одного химического элемента в ядро другого химического элемента, а также выделением энергии, которая "уносится" с альфа- бета- и гамма-излучениями. Все радиоактивные элементы подвержены радиоактивным превращениям. В некоторых случаях у радиоактивного элемента наблюдается альфа- и бета-излучения одновременно. Чаще химическому элементу присуще или альфа-излучение, или бета-излучение. Альфа- или бета- излучения часто сопровождаются гамма- излучением. Испускание радиоактивных частиц называется радиоактивным распадом. Различают альфа-распад ( с испусканием альфа-частиц), бета-распад (с испусканием бета-частиц), термина "гамма-распад" не существует. Альфа- и бета-распады – это естественные радиоактивные превращения.
Альфа - распад
Альфа-частицы испускаются только тяжелыми ядрами, т.е. содержащими большое число протонов и нейтронов. Прочность тяжелых ядер мала. Для того, чтобы покинуть ядро, нуклон должен преодолеть ядерные силы, а для этого он должен обладать достаточной энергией. При объединении двух протонов и двух нейтронов в альфа-частицу ядерные силы в подобном сочетании (между нуклонами частицы) являются наиболее крепкими, а связи с другими нуклонами слабее, поэтому альфа-частица способна "выйти" из ядра. Вылетевшая альфа-частица уносит положительный заряд в 2 единицы и массу в 4 единицы. В результате альфа-распада радиоактивный элемент превращается в другой элемент, порядковый номер которого на 2 единицы, а массовое число на 4 единицы, меньше.
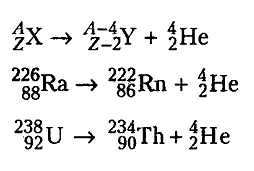 То
ядро, которое распадается, называют
материнским, а образовавшееся
дочерним.
Дочернее
ядро оказывается обычно тоже радиоактивным
и через некоторое время распадается.
Процесс
радиоактивного распада происходит до
тех пор,
пока не появится стабильное ядро, чаще
всего ядро свинца или висмута.
То
ядро, которое распадается, называют
материнским, а образовавшееся
дочерним.
Дочернее
ядро оказывается обычно тоже радиоактивным
и через некоторое время распадается.
Процесс
радиоактивного распада происходит до
тех пор,
пока не появится стабильное ядро, чаще
всего ядро свинца или висмута.
Бета-распад
Явление
бета-распада состоит в том, что ядра
некоторых элементов самопроизвольно
испускают электроны и
элементарную частицу очень малой массы
- антинейтрино.
Так
как электронов в ядрах нет, то появление
бета-лучей из ядра атома можно объяснить
способностью нейтронов ядра распадаться
на протон, электрон и антинейтрино.
Появившийся протон переходит во вновь
образующееся ядро. Электрон, вылетающий
из ядра, и является частицей
бета-излучения.
Такой
процесс распада нейтронов характерен для
ядер с большим количеством нейтронов.
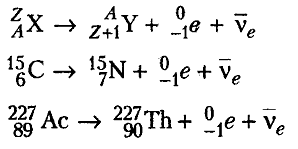 В
результате бета-распада образуется
новое ядро с таким же массовым числом,
но с большим на единицу зарядом.
В
результате бета-распада образуется
новое ядро с таким же массовым числом,
но с большим на единицу зарядом.
Гамма - распад - не существует В процессе радиоактивного излучения ядра атомов могут испускать гамма-кванты. Испускание гамма-квантов не сопровождается распадом ядра атома. Гамма излучение зачастую сопровождает явления альфа- или бета-распада. При альфа- и бета-распаде новое возникшее ядро первоначально находится в возбужденном состоянии и , когда оно переходит в нормальное состояние, то испускает гамма-кванты (в оптическом или рентгеновском диапазоне волн).
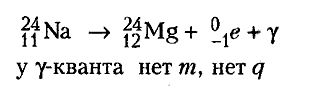 Так
как радиоактивное излучение состоит
из альфа-частиц, бета-частиц и гамма-квантов
(т.е. ядер атома гелия, электронов и
гамма-квантов), то явление радиоактивности
сопровождается потерей массы и
энергии ядра, атома и вещества в
целом.
Доказательством того, что
радиоактивное излучение несет энергию,
является опыт, показывающий, что при
поглощении радиоактивного излучения
вещество нагревается.
Так
как радиоактивное излучение состоит
из альфа-частиц, бета-частиц и гамма-квантов
(т.е. ядер атома гелия, электронов и
гамма-квантов), то явление радиоактивности
сопровождается потерей массы и
энергии ядра, атома и вещества в
целом.
Доказательством того, что
радиоактивное излучение несет энергию,
является опыт, показывающий, что при
поглощении радиоактивного излучения
вещество нагревается.
Химическая связь и строение молекул.
8. а) Образование молекул- Как известно, атомы любят соединяться в молекулы. Большинство из окружающих нас веществ состоит именно из молекул. Даже простейшее вещество - газ водород, и тот состоит из молекулы, причем каждая молекула водорода в свою очередь состоит из двух атомов.
Как же устроена молекула водорода? Очень просто. Два протона и при каждом по электрону. Вот и все, как говорится, проще не придумаешь. Но возникает вопрос, почему эти два атома водорода держатся вместе, а не разбредаются в разные стороны? Ведь как мы уже знаем, вне атома электромагнитного поля почти что нет. Раз нет поля, значит, действовать атомы друг на друга не могут. Даже если бы и могли, протон одного атома заряжен положительно, соответственно может притягивать к себе электрон другого атома и с такой же точно силой отталкивать протон другого атома. Электрон первого атома заряжен отрицательно, он притягивает к себе протон второго атома и с такой же силой отталкивает электрон второго атома. Силы притяжения и отталкивания в точности равны. Т.е. никакой силы, удерживающей атомы водорода друг возле друга, быть не может.
Можно было бы предположить, что каким-то образом расстояние между протоном первого атома и электроном второго атома стало чуть поменьше, чем расстояние между протонами. Тогда, вероятно, могла бы возникнуть сила притяжения. Но ведь сказать, что между двумя электронами или между электроном и протоном имеется какое-то расстояние, это то же самое, что эти самые электроны находятся в определенных местах. А мы уже знаем, что, по крайней мере, среди атомов говорить о каком-то месте, где находится электрон, совершенно бессмысленно.
Но атомы водорода все-таки удерживаются друг возле друга и причина вот в чем. Представьте, что есть два атома водорода, находящиеся очень далеко друг от друга. Каждый атом обладает определенной энергией, и система, состоящая из двух атомов, также обладает энергией, равной в точности сумме энергий обоих атомов. Теперь постепенно сближаем эти атомы. Поначалу ничего вроде бы не происходит. Но если приблизить атомы друг к другу на расстояние в несколько ангстрем, произойдет следующее. Оба электрона образуют вокруг обоих протонов общее электромагнитное поле. Почему бы и нет, в атоме гелия такое же есть.
Посмотрите на рисунок, точнее, на график ниже. По горизонтальной оси отложено расстояние между протонами, по вертикальной - энергия системы, состоящей из двух атомов водорода. График энергии для электронов изображен синей линией. Расстояние уменьшается, электроны начинают занимать пространство вокруг обоих протонов, потенциальная энергия электронов уменьшается. Красной линией показан график энергии протонов. Эта энергия убывает с расстоянием. Если просуммировать ординаты двух построенных графиков, то получится полная энергия системы, состоящей из двух атомов. Сплошной черной линией такая сумма и показана на рисунке. А дальше все очень просто. Видите, есть расстояние, при котором энергия системы минимальна. Поскольку природа ленива, если есть возможность получить систему с минимальной энергией, она (природа) обязательно использует эту возможность.
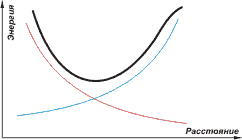
Получается молекула, система из двух атомов водорода, расположенных друг относительно друга так, что их общая энергия минимальна. Но не любые два атома водорода могут образовать молекулу. В молекуле водорода оба электрона вывернуты наизнанку вокруг обоих протонов., т.е. находятся в одинаковых состояниях. А мы теперь хорошо знаем, что в одинаковых состояниях два электрона могут находиться только тогда, когда их спины направлены в противоположные стороны. Следовательно, молекула водорода может образоваться только из таких двух атомов, электроны которых имеют противоположно направленные спины.
Примерно то же самое происходит при образовании любых молекул, составленных из атомов различных веществ. Какая-то часть электронов этих атомов становится общей и обеспечивает минимум общей энергии системы, состоящей из нескольких атомов. Общим может стать не любое количество, а лишь такое, при котором в одном и том же энергетическом состоянии оказывается не больше двух электронов с противоположно направленными спинами.
Связь между атомами, обеспечиваемая общими электронами, называется ковалентной связью. А количество электронов, которое атом может отдать на общее благо, или наоборот, количество электронов, которое атом может принять от другого атома, называется валентностью данного вещества. Что такое валентность, усиленно мусолится на химии, а здесь мы уяснили, отчего она зависит.
Кстати, бывает и по-другому. Встречаются, к примеру, два атома, и электрон от одного атома уходит к другому - ему там больше нравится, ну или простора больше. Соответственно меньшей становится общая энергия системы. Но раз электрон ушел, то все, что осталось от покинутого атома, заряжено положительно, а атом, к которому ушел электрон, заряжен отрицательно. Возникает сила притяжения, которая удерживает атомы в молекуле. Такая связь между атомами называется ионной. При такой связи законы валентности сохраняются.
Б) Молекулярные орбитали- Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойствамолекул. В этой теории квантовомеханические зависимости для атома распространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы.
Предполагается, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Состояние электрона в атоме описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). Каждая орбиталь характеризуется своим набором квантовых чисел, отражающих свойства электронов в данном энергетическом состоянии. В отличие от одноцентровых орбиталей атомов, орбитали молекул многоцентровые, то есть молекулы имеют общие орбитали для двух или более атомных ядер. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации.
По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, γ-. МО образуются при комбинировании атомных орбиталей при достаточном сближении. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы. Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участия в образовании химической связи не принимают. Из исходных атомных орбиталей возникает n МО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σsсв), другая менее выгодная (разрыхляющая σsразр), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. На разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга.
Характер распределения электронов по МО определяет порядок (кратность) связи, её энергию, межъядерные расстояния (длина связи), магнитные свойства молекул и др. Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, принципу заполнения электронных структур Aufbau. В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей (приближение МО ЛКАО).
Кратность связи в теории молекулярных орбиталей определяется выражением
![]()
где ![]() и
и ![]() —
суммарные количества электронов на
связывающих и разрыхляющих орбиталях
соответственно.
—
суммарные количества электронов на
связывающих и разрыхляющих орбиталях
соответственно.
В) Валентность - способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
9. А) Ковалентная связь и ее виды- Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называетсянеполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
Б) Обменный и донорно-акцепторный механизмы образования ковалентной связи-
В) Свойства ковалентной связи – Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Г) Гибридизация атомных орбиталей - Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π-связью.
В линейной молекуле ацетилена
Н—С≡С—Н (Н : С ::: С : Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π-связи между этими же атомами углерода. Две π-связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π-связи, а единая π-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
10. А) Ионная связь, свойства ионной связи – Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общаяэлектронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная параполностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
![]()
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Б) степень ионной связи – ???????????
В) Поляризация молекул- процессы и состояния, связанные с разделением каких-либо объектов, преимущественно в пространстве. В жестких диполях цетр масс положительных зарядов (ядер) не совпадает с центром масс отрицательных зарядов (электронных оболочек). Если эти центры масснаходятся в одной точке, то молекула является неполярной. Однако, помещенная в электрическое поле она может приобретать свойства диполя, так как может происходить смещение зарядов под действием сил электрического поля. Такое явление называется поляризацией Явление поляризации молекул в электрическом поле связано со следующими процессами: - образованием индуцированного диполя вследствие смещения электронов - электронная поляризация Pel; - смещением или поворотом атомов и полярных групп атомов в молекуле - атомная поляризация Pat; - в случае, когда находящиеся в электрическом поле молекулы являются диполями, они устанавливаются в положения, соответствующие минимумуму энергии системы - ориентационная поляризация Por. Общая поляризация является суммой этих трех величин:
|
(1) |
Зависимость между поляризацией P, диэлектрической постоянной ε и полязуемостью α выражается уравнением Клаузиуса-Моссотти:
|
(2) |
Анализ справедливости этого соотношения приведен в статье БСЭ Разложение поляризуемости молекулы на три компонента: - электронную поляризуемость αel; - атомную поляризуемость αat; - ориентационную поляризуемость αor позволяет записать (1) в виде:
|
(3) |
Ориентационная поляризация Por по Дебаю равна:
|
(4) |
Электронная поляризуемость αel приблизительно равна:
|
(5) |
Тогда для некоторых неполярных молекул ( αat и αor) полярность равна:
|
(6) |
где vmol - объем молекулы равен:
|
(7) |
Так как постоянная b в уравнении Ван-дер-Ваальса равна собственному учетверенному собственному объему молекул Vmol, содержащихся в одном моле, то (6) примет вид:
|
(8) |
Соотношение (8) является оценочным. Более точным выражением для неполярных молекул является следующее равенство:
|
(9) |
Данное равенство вытекает из сравнения определения полярности - соотношение (2) и формулы Лорентца-Лоренца для определения мольной рефракции, а также того факта, что Patсоставляет в среднем 3-5% от Pel (в исключительных случаях - 15%).
Г)
Дипольный момент – Дипольный
момент электрический,
векторная величина, характеризующая
асимметрию распределения положительных
и отрицательных зарядов в электрически
нейтральной системе. Два одинаковых по
величине заряда +qи —q образуют
электрический диполь с дипольный момент
m = q
l, где l -
расстояние между зарядами. Для системы
изn зарядов qi радиусы-векторы
которых ri, 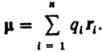 В молекулах и
молекулярных системах центры положительных
зарядов qА совпадают
с положениями атомных
ядер (радиусы-векторы rA),
а электронное распределение описывается
плотностью вероятности r(r).
11. А)
Металлическая связь –
В молекулах и
молекулярных системах центры положительных
зарядов qА совпадают
с положениями атомных
ядер (радиусы-векторы rA),
а электронное распределение описывается
плотностью вероятности r(r).
11. А)
Металлическая связь –
Б) Водородная связь – форма ассоциации между электроотрицательным атомом и атомом водорода H, связаннымковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O илиF. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1] Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+ образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
В) Типы кристаллических решеток – Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические
решетки, состоящие из ионов,
называются ионными.
Их образуют вещества с ионной связью.
Примером может служит кристалл хлорида
натрия, в котором, как уже отмечалось,
каждый ион натрия окружен шестью
хлорид-ионами, а каждый хлорид-ион -
шестью ионами натрия. Такому расположению
соответствует наиболее плотная упаковка,
если ионы представить в виде шаров,
размещенных в кристалле . Очень часто
кристаллические решетки изображают,
как показано на рис 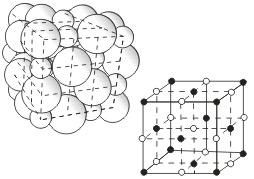 ,
где указывается только взаимное
расположение частиц, но не их размеры.
,
где указывается только взаимное
расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические
решетки, в узлах которых находятся
отдельные атомы, называются атомными.
Атомы в таких решетках соединены между
собой прочными ковалентными связями.
Примером может служить алмаз - одна из
модификаций углерода. Алмаз состоит из
атомов углерода, каждый из которых
связан с четырьмя соседними атомами.
Координационное число углерода в алмазе
4  .
В решетке алмаза, как и в решетке хлорида
натрия, молекулы отсутствуют. Весь
кристалл следует рассматривать как
гигантскую молекулу. Атомная кристаллическая
решетка характерна для твердого бора,
кремния, германия и соединений некоторых
элементов с углеродом и кремнием.
.
В решетке алмаза, как и в решетке хлорида
натрия, молекулы отсутствуют. Весь
кристалл следует рассматривать как
гигантскую молекулу. Атомная кристаллическая
решетка характерна для твердого бора,
кремния, германия и соединений некоторых
элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами
их являются лед, твердый оксид углерода
(IV) ("сухой лед"), твердые
галогеноводороды, твердые простые
вещества, образованные одно- (благородные
газы), двух- (F2,
Сl2,
Br2,
I2,
Н2,
О2,
N2),
трех- (О3),
четырех- (Р4),
восьми- (S8)
атомными молекулами. Молекулярная
кристаллическая решетка йода показана
на рис 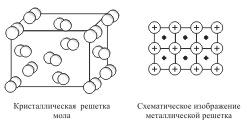 .
Большинство кристаллических органических
соединений имеют молекулярную решетку.
.
Большинство кристаллических органических
соединений имеют молекулярную решетку.
12. А) Виды межмолекулярного взаимодействия - Виды межмолекулярных взаимодействийОснову межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (дипольного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентациямолекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды межмолекулярных взаимодействий можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на некоторую условность, такое деление в каждом конкретном случае позволяет объяснять природу межмолекулярного взаимодействия и рассчитать его энергию.
Б) Ван-дер-Ваальсовы силы - силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами.[1][2][3]
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
До сих пор многие авторы исходят из предположения, что ван-дер-ваальсовые силы определяют межслоевое взаимодействие в слоистых кристаллах, что противоречит экспериментальным данным: масштабу анизотропии температуры Дебая и, соответственно, масштабу анизотропии решёточного отражения. Исходя из данного ошибочного[4]предположения построены многие двумерные модели, «описывающие» свойства, в частности графита и нитрида бора.
Химическая кинетика.
13. А) Система –Химические системы
Можно сказать что до открытия в 1869 г. периодической системы химических элементов Дмитрием Ивановичем Менделеевым (1834—1907) не существовало той объединяющей системы, с помощью которой можно было бы объяснить весь накопленный фактический материал, а следовательно, представить все наличное знание как систему теоретической химии. Характер любой химической системы, как известно, зависит не только от состава и строения ее элементов, но и от их взаимодействия. Именно такое взаимодействие определяет специфические, целостные свойства самой системы. Поэтому при исследовании разнообразных веществ и их реакционной способности ученым приходилось заниматься и изучением их структур. Соответственно уровню достигнутых знаний менялись и представления о химической структуре веществ. Хотя разные ученые по-разному истолковывали характер взаимодействия между элементами химических систем, тем не менее все они подчеркивали, что целостные свойства этих систем определяются именно специфическими особенностями взаимодействия между их элементами. В качестве первичной химической системы рассматривалась при этом молекула, и поэтому, когда речь заходила о структуре веществ, то имелась в виду именно структура молекулы как наименьшей единицы вещества.
Б) Фаза- Фаза состояния - однородная по химическому составу и физическим свойствам часть вещества
В) Гомогенные и гетерогенные системы – Буквально гетерогенные системы значит разнородные, а гомогенные — однородные системы; при этом, однако, есть ряд подразумеваемых допущений, почему вопрос заслуживает более подробного рассмотрения. "Материя (Le-Chatelier, "An. d. m.", 9, 131—135 [1897]) может являться в двух состояниях, между которыми имеется резко выраженное различие и которые не могут быть связаны друг с другом рядом непрерывных промежуточных состояний: это состояния — кристаллическое и аморфное. Кристаллическое состояние характеризуется тем, что свойства материи ориентированы в пространстве, т. е. меняются вокруг каждой точки в зависимости от избранного направления... на первом месте тут должна быть поставлена способность влиять на скорость света..., затем, теплопроводность... и, наконец, внешняя геометрическая форма"; к этой характеристике можно бы прибавить и различную скорость растворения кристаллов по различным плоскостям (ср. Lehmann, "Molekularphysik", I, 491—501). "Аморфное состояние, — продолжает Ле-Шателье, — это не кристаллическое состояние; в аморфной материи все свойства, каковы бы они ни были, тождественны вокруг всякой точки и по всем направлениям. Таковыми являются все жидкие, газообразные и так называемые стеклообразные тела", являющиеся примерами гомогенных систем. На основании приведенной цитаты следовало бы все кристаллические тела считать Г. системами, но принято, однако, называть и их гомогенными, если в них не наблюдается каких-нибудь видимых плоскостей раздела, указывающих на сосуществование по крайней мере двух фаз (пар твердого тела, как невидимый, при этом игнорируют); можно считать этот обычай до некоторой степени оправдываемым тем, что в массе кристаллического тела, особенно, если оно образовано сплетением мелких кристаллов, ориентировка свойств не подчинена никакому закону, она вполне беспорядочна и в силу этого является вероятность "средней однородности" ("средней аморфности"?) данного тела. Затем, когда мы говорим о Г. системах, то мы подразумеваем гетерогенность равновесных систем, где сосуществующие фазы разделены видимыми поверхностями раздела, поверхностями, на которых наблюдаются резкие разрывы сплошности физических свойств и химической концентрации, но которые могут с изменением условий (факторов равновесия) перемещаться в том или другом направлении; а потому жидкость, запаянная в стеклянном сосуде, при отсутствии пара и отвечающего ей твердого тела, считается, напр., нами гомогенной, а не Г. системой (стекло не рассматривается как естественная часть системы); вода и ее пар, вода и лед, раствор над избытком твердого ("кристаллического") растворенного тела (насыщенный раствор) — примеры Г. систем. Как известно из правила фаз (см. "Закон фаз", "Физико-математический Ежегодн.", II, 174), чем богаче данная система фазами, тем меньшим числом степеней свободы она располагает, тем она определеннее; несмотря на это, такие системы привлекли на себя внимание главным образом в последнее время (работы Роозебоома, фан'т-Гоффа и др.), а большинство работ и до сих пор посвящено "гомогенным" системам; обыкновенно, впрочем, их свобода ограничивается выбором определенной температуры опыта, игнорированием влияния давления на ход превращения, благо оно почти не сказывается при грубых способах исследования, игнорированием сосуществующей газообразной фазы, если изучаются свойства раствора и т. д. Об особом случае гетерогенности, создаваемом неоднородностью давления в разных точках системы, см. Le Chatelier, "Z. ph. Ch." (9, 335 [1892]).
Г) Скорость химических реакций в гомогенных и гетерогенных системах – Скорость гетерогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы. 1Величину поверхности твердого тела не всегда легко измерить. Поэтому иногда скорость гетерогенной реакции относят не к единице поверхности, а к единице массы или объема твердой фазы.
Оба этих определения можно записать в математической форме. Введем обозначения: vгомог — скорость реакции в гомогенной системе; vгетерог — скорость реакции в гетерогенной системе; n — число молей какого-либо из получающихся при реакции веществ; V — объем системы; t — время; S -— площадь поверхности фазы, на которой протекает реакция; — знак приращения (n= n2-n1; = t2-t1). Тогда: vгомог=n/(St).
Первое из этих уравнений можно упростить. Отношение числа молей (n) вещества к объему (V) системы представляет собою мольно-объемную концентрацию (С) данного вещества: n/V=C. Отсюда: n/V=C. И окончательно:
vгомог=C/t. Последнее уравнение является математическим выражением другого определения скорости реакции в гомогенной системе: скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее в единицу времени. Как уже говорилось, при практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью. Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции, важнейшими из которых являются следующие: концентрация с, температура t, присутствие катализаторов, а также от некоторых других факторов (например, от давления — для газовых реакций, от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция, от измельчения — для твердых веществ, от радиоактивного излучения). Влияние концентрации реагирующих веществ, Чтобы осуществилось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: Скорость химической реакции пропорциональна произведению реагирующих веществ. Для реакции A+B=C+D этот закон выразится уравнением: v = kcAcB, (12.1) где сA и сB — концентрации веществ А и В, моль/л; k — коэффициент пропорциональности, называемый константой скорости Реакции. Основной закон химической кинетики называют законом действующих масс.
Из уравнения (12.1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляет 1 моль/л или когда их произведение равно единице. Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентрации. Уравнение (12.1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислить скорости при других концентрациях тех же реагирующих веществ. Основной закон химической кинетики не учитывает реагирующие вещества, находящиеся в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности. Так, например, для реакции горения угля: С+O2=СО2 кинетическое уравнение реакции имеет вид: v = kcCSсO2, где k — константа скорости, сC — концентрация твердого вещества; S — площадь поверхности. Это величины постоянные. Обозначив произведение постоянных величин через k', получим v=k'cO2, т.е. скорость реакции пропорциональна только концентрации кислорода. Влияние температуры. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: При повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза. Математически эта зависимость выражается соотношением; vt2=vt1•(t2-t1)/10, (12.2) где vt1, vt2 — скорости реакции соответственно при начальной (t1) и конечной (t2) температурах, а — температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°. Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
14. А) Закон действия масс – акон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведениюконцентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
![]()
закон действующих масс может быть записан в виде кинетического уравнения вида:
![]()
где ![]() — скорость
химической реакции,
— скорость
химической реакции, ![]() — константа
скорости реакции.
— константа
скорости реакции.
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми[2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:
![]()
(для
трех исходных веществ, аналогично
приведённому выше уравнению).
Здесь ![]() ,
, ![]() ,
, ![]() — порядок
реакции по
веществам
— порядок
реакции по
веществам ![]() ,
, ![]() ,
, ![]() соответственно,
а сумма
соответственно,
а сумма ![]() —
общий (или суммарный) порядок
реакции.
,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные.
при
определённых условиях может быть равно
и нулю.
—
общий (или суммарный) порядок
реакции.
,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные.
при
определённых условиях может быть равно
и нулю.
Б) Константа скорости химической реакции – Химическая кинетика изучает скорость химических процессов и зависимость их от различных факторов. Кинетические исследования позволяют определить порядок и константу скорости реакции, число и характер промежуточных продуктов, энергию активации реакции, выявить влияние природы растворителя, установить характер и число связей, разрываемых в ходе реакции и так далее.
Порядок реакции определяется величиной показателя степени при концентрации в уравнении скорости, то есть в выражении закона действующих масс:
![]()
каждый из показателей степени при концентрациях в уравнении скорости выражает частный порядок реакции. Сумма показателей степени при концентрациях определяет общий порядок реакции, например:
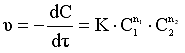
где: n1 и n2 - частные порядки, а (n1+n2) - полный порядок реакции.
Если порядок равен единице, то реакцию называют реакцией первого порядка, если двум - второго порядка и так далее.
Скорость химических реакций растет с повышением температуры. Зависимость скорости гомогенной химической реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа: при нагревании на 10° скорость увеличивается в 2-4 раза, то есть:
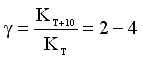
где: КТ+10 - константа скорости при температуре Т+10, КТ - константа скорости той же реакции при температуре Т.
Отношение ![]() называется
температурным коэффициентом скорости
химической реакции и обозначается
обычно γ.
называется
температурным коэффициентом скорости
химической реакции и обозначается
обычно γ.
Более точно зависимость скорости реакции от температуры передается уравнением Аррениуса:
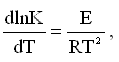
где: К - константа скорости реакции, Т - температура (К), R - универсальная газовая постоянная, Е - энергия активации химической реакции.
Для небольшого интервала температур (Т1≠Т2) величину Е можно считать постоянной. После интегрирования уравнения с учетом этих условий получаем:
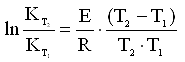
Если R выразить через Дж/моль•град (8,31 Дж/моль•град), то опытная энергия активации имеет размерность Дж/моль.
В) Факторы, влияющие на скорость химической реакции – Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции ( I ) этот закон выразится уравнением
v = kcA cB , (1)
где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Из уравнения (1) нетрудно установить физический смысл константы скорости k : она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Влияние температуры .
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
![]()
vt 2 = vt 1 γ ,
где vt 1 , vt 2 - скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Г) Катализаторы – химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз)[источник?] повторяется. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Д) Правило Вант-Гоффа – мпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
-
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Е) Темперптурный коэффициент реакции – ????????????
Ж) Энергия активации - Сильное изменение скорости реакции с изменением температуры объясняет теория активации. Согласно этой теории в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными,если сообщить им необходимую дополнительную энергию, - этот процесс называется активацией. Один из способов активации - увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость.
Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации.
Ее определяют опытным путем, обозначают буквой Еa и обычно выражают в кДж/моль. Так, например, для соединения водорода и иода (Н2 + I2 = 2НI) Еа = 167,4кДж/моль, а для распада иодоводорода (2НI = Н2 + I2) Еа = 186,2 кДж/моль.
Энергия активации
Еa зависит
от природы реагирующих веществ и служит
характеристикой каждой реакции. Эти
представления поясняются
рисунком:
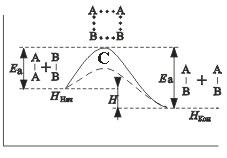 на примере
реакции в общем виде А2 + В2 =
2АВ. Ось ординат характеризует
потенциальную энергию системы, ось абсцисс -
ход реакции: исходное
состояние →переходное состояние
→ конечное состояние. Чтобы реагирующие
вещества А2 и В2 образовали продукт
реакции АВ, они должны преодолеть
энергетический барьер С.На
это затрачивается энергия
активации Еа, на значение
которой возрастает энергия системы. При
этом в ходе реакции из частиц реагирующих
веществ образуется
промежуточная неустойчивая
группировка, называемая переходным
состоянием или активированным
комплексом (в
точке С), последующий распад которого приводит к образованию конечного
продукта АВ. Механизм реакции можно
изобразить схемой
на примере
реакции в общем виде А2 + В2 =
2АВ. Ось ординат характеризует
потенциальную энергию системы, ось абсцисс -
ход реакции: исходное
состояние →переходное состояние
→ конечное состояние. Чтобы реагирующие
вещества А2 и В2 образовали продукт
реакции АВ, они должны преодолеть
энергетический барьер С.На
это затрачивается энергия
активации Еа, на значение
которой возрастает энергия системы. При
этом в ходе реакции из частиц реагирующих
веществ образуется
промежуточная неустойчивая
группировка, называемая переходным
состоянием или активированным
комплексом (в
точке С), последующий распад которого приводит к образованию конечного
продукта АВ. Механизм реакции можно
изобразить схемой
|
|
|
|
|
|
исходные реагенты (начальное состояние системы) |
|
активированный комплекс (переходное состояние) |
|
продукты реакции (конечное состояние системы) |
|
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая.Примером эндотермической реакции служит обратный процесс - образование из вещества АВ веществ А2 и В2: 2АВ = А2 + В2. В этом случае процесс протекает также через образование активированного комплекса А2В2, однако энергия активации больше, чем для прямого процесса: Еа = Еа + ∆H (∆H - тепловой эффект реакции).Для протекания эндотермических реакций требуется подвод энергии извне.
Как видно из рисунка разность энергий конечного состояния системы (Hкон) и начального (Hнач) равна тепловому эффекту реакции:
∆H = Hкон - Hнач.
Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).
К)
уравнение Аррениуса – Уравне́ние
Арре́ниуса устанавливает
зависимость константы скорости химической
реакции
от температуры ![]() .
.
Согласно
простой модели столкновений химическая
реакция между двумя исходными веществами
может происходить только в результате
столкновения молекул этих
веществ. Но не каждое столкновение ведёт
к химической реакции. Необходимо
преодолеть определённый энергетический
барьер, чтобы молекулы начали друг с
другом реагировать. То есть молекулы
должны обладать некой минимальной
энергией (энергия
активации ![]() ),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией
),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией ![]() ,
пропорционально
,
пропорционально ![]() .
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
.
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
![]()
Здесь ![]() характеризует
частоту столкновений реагирующих
молекул,
характеризует
частоту столкновений реагирующих
молекул, ![]() — универсальная
газовая постоянная.
— универсальная
газовая постоянная.
В рамках теории активных соударений зависит от температуры, но эта зависимость достаточно медленная:
![]()
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений A на 10 %.
В рамках теории активированного комплекса получаются другие зависимости от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Химическое равновесие.
15. А) Обратимые необратимые процессы- Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Необратимые
процессы могут протекать самопроизвольно
только в одном направлении;
таковы диффузия,теплопроводность,
вязкое течение и другое. Для химической
реакции применяют понятия термодинамической
и кинетической обратимости, которые
совпадают только в непосредственной
близости к состоянию равновесия. Р-ция
А + В ![]() С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв.
С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв. ![]()
![]() ,
где
,
где ![]() и
и ![]() -константы
скорости, [А], [В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие,
в котором
-константы
скорости, [А], [В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие,
в котором![]() -константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
-константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Например, образец закаленной стали обладает пространственной неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы механической деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
Б)
Константа химического равновесия –
Конста́нта
равнове́сия —
величина, определяющая для данной химической
реакции соотношение
между термодинамическими активностями (либо,
в зависимости от условий протекания
реакции, парциальными
давлениями, концентрациями или фугитивностями)
исходных веществ и продуктов в
состоянии химического
равновесия (в
соответствии с законом
действующих масс).
Зная константу равновесия реакции,
можно рассчитать равновесный состав
реагирующей смеси, предельный выход
продуктов, определить направление
протекания реакции.
Стандартная константа равновесия
реакции в смеси идеальных газов (когда
начальные парциальные давления участников
реакции равны их значениям в стандартном
состоянии ![]() =
0,1013 МПа или 1 атм) может быть рассчитана
по выражению:
=
0,1013 МПа или 1 атм) может быть рассчитана
по выражению:
![]()
где ![]() —
относительные парциальные давления
компонентов,
—
относительные парциальные давления
компонентов, ![]() .
.
Стандартная константа равновесия — безразмерная величина. Она связана с Kp соотношением:
![]()
Видно,
что если
выражены
в атмосферах, то ![]() и
и ![]() .
.
Для
реакции в смеси реальных газов в
стандартном начальном состоянии
парциальные фугитивности газов
принимаются равными их парциальным
давлениям ![]() =
0,1013 МПа или 1 атм. Kf связана
с K0 соотношением:
=
0,1013 МПа или 1 атм. Kf связана
с K0 соотношением:
![]()
где γi — коэффициент фугитивности i-го реального газа в смеси.
В) Равновестные концентрации – Так как равновесные концентрации зольных примесей должны быть весьма малы, мы могли ожидать заметных эффектов очистки лишь при достаточно высоких градиентах потенциала. Обычно в наших опытах мы пользовались градиентами потенциала около 150 в/см.[8, С.53] Исходные и равновесные концентрации растворов солей определяли как по катионам, так и по анионам. Концентрации катионов определяли объемно-весовым титрованием [2] трилоном (Б) по эриохрому черному (Т) [3], а ионов хлора — титрованием нитратом ртути (П) с применением в качестве индикатора спиртового раствора дифенилкарбазона и бромфенолблау [4].[6, С.462] Если учесть, что равновесные концентрации х" одинаковы и не зависят от исходной концентрации раствора, а концентрация полимера в низкоконцентрированной фазе х' практически равна нулю, то согласно правилу рычага доля объема второй фазы будет соответствовать величинам: для первого случая — x\lx", a для второго — х2/х". Соотношение этих фаз между собой будет, следовательно, равно отношению исходных концентраций полимера, т. е. х\1х%. В первом случае после распада на две фазы образуется значительно большее количество включенной в полимерный остов жидкости, чем во втором случае.[5, С.311] Липатов предположил, что существуют равновесные концентрации студней, выше которых синерезис не идет, Не такое предположение не согласуется ни с одной из гипотез о строении студней. В частности, согласно гипотезе о ячеистом строении студней синерезис должен идти до полного разделения фаз. Равновесная система предполагает полное разделение фаз. Чем можно объяснить синерезис низкоконцентрированных студней? Согласно гипотезе о ячеистом строении студней низ'ковяз-кая фаза замкнута в ячейках, стенки которых обладают вышкой вязкостью и проницаемы только для низкомо-лекулярных жидкостей, но не для полимера, который содержится в синеретической жидкости. Чистый же растворитель не может покинуть ячейку, не вызвав увеличения осмотического давления в ней.[5, С.190] Поскольку одним из факторов, влияющих на равновесные концентрации сосуществующих фаз, должна являться кинетическая подвижность молекул компонентов, вполне естественно ожидать, что кривая расслоения для системы полимер—растворитель будет резко сдвинута и область очень низких концентраций полимера, лпнстнчегкяя подвижность молекул (сегментов) которого мала но сравнению с кинетической подвижностью молекул растворителя. Действительно, во всех практически изученных системах равновесные концентрации первой фазы (условно называемой раствором полимера в растворителе в отличие от второй фазы — раствора раство-|)::тедя в полимере) очень малы. Например, для систем ацетат целлюлозы — хлороформ и поливинилацеталь —[5, С.38] Определять равновесные концентрации макро- и микрометодами можно как объемным [85—87, 89, 90, 92], так и весовым способом [81—84, 93].[7, С.246] Там же, где равновесные концентрации в интермицеллярной жидкости практически равны нулю, или там, где достигнуто адсорбционное насыщение поверхности первоначальным веществом, можно ожидать эквивалентности при обмене на другое вещество. Подобные случаи могут быть реализованы в грубогетерогенных системах, что же касается лиофобных коллоидных систем, то, как было уже указано, первый случай не наблюдается среди изученных золей, второй случай неосуществим ввиду неминуемого выпадения золя при концентрациях электролита, соответствующих адсорбционному насыщению.[8, С.106] Здесь [АтД„] — равновесная концентрация КПЗ, [А]т и [Д]п— равновесные концентрации свободного акцептора и донора.[2, С.10] При этом вследствие того, что изотерма адсорбции H2S04 проходит круче, чем изотерма HG1, равновесные концентрации кислот будут ниже, чем в случае чистой НС1. Таким образом, количество кислот, находящихся в растворе в равновесии с осадком, будет меньше, а количество сорбированных кислот — больше, чем в исходной системе, содержащей лишь чистую НО. Это должно привести к тому, что адсорбция 804а~-ионов будет превышать количество вытесненных С1~-ионов и эквивалентность не будет соблюдаться. Величины отклонений от эквивалентных отношений будут[8, С.116] В макроопределениях, из которых наибольшего внимания заслуживает метод салазок Зигнера [85], измеряются конечные равновесныеконцентрации растворов, из которых определяют величину молекулярного веса исследуемого вещества.[7, С.246] Описанные явления, естественно, должны привести к неэквивалентности ионного обмена при коагуляции. Эти явления происходят в тех случаях, где имеются высокие равновесные концентрации адсорбирующихся электролитов в интермицеллярной жидкости, так как неэквивалентность обмена вызывается изменением равновесной концентрации первоначального адсорбированного вещества.[8, С.106]
Г) Принцип Ле Шателье – При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. РеакцияCO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
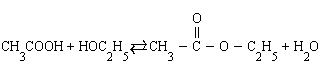
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
Д) Смещение химического равновесия при изменении темпиратуры и т.д. - Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Реагенты |
Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты. Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Fe + S FeS |
Пример. Реакция синтеза аммиака является обратимой:
N2 + 3H2 2NH3 |
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается. Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
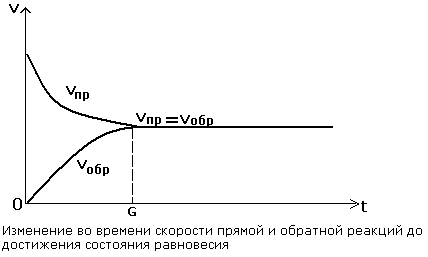
В состоянии равновесия скорости прямой и обратной реакции становятся равными.