
- •Билет №1
- •1. Конденсационные методы получения лиофобных дисперсных систем.
- •2. Особенности адсорбции ионов и молекул из растворов на твердой поверхности.
- •3. Реология
- •4. Сравните давление насыщенного пара над одинаковыми по размерам каплями воды и пропилового спирта.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - ВеСl2, в - nh4oh, с - Be(oh)2
- •Билет 2
- •1. Диспергационные методы получения лиофобных дисперсных систем.
- •2. Межфазная поверхность, ее силовое поле. Поверхностное натяжение как характеристика этого поля
- •3. Что Вы знаете о структурообразовании в дисперсных системах и типах дисперсных структур?
- •4. Сравните давление насыщенного пара над каплями эквиконцентрированных водных растворов уксусной и масляной кислот (радиусы капель одинаковы). Ответ обоснуйте.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А: k2CrO4, b: AgNo3, c: Ag2CrO4
- •1. Седиментационный анализ суспензий и эмульсий.
- •2. Поверхностная активность. Экспериментальное определение, изменение в гомологических рядах, работа адсорбции.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na2 SiO3, в - hCl, с - h2SiO3
- •Билет 4
- •1. Смачивание и растекание:
- •2 Метод избыточных величин Гиббса и метод слоя конечной толщины
- •3. Дайте определение поверхностной активности и поясните выражение «понятие поверхностной активности относительно». Как экспериментально оценить поверхностную активность?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А (NaCl), в (kh2SbO4), с (NaH2SbO4).
- •Билет 5
- •1. Седиментационный анализ в центробежном поле как метод оценки размеров коллоидных частиц и макромолекул полимеров.
- •2. Адсорбция и ее характеристики. Теории полимолекулярной адсорбции.
- •3. Что такое аэрозоли? Чем обусловлены их специфические свойства и как их разрушают?
- •4. С каким коллоидно-химическим явлением в организме человека связано чувство жажды? Охарактеризуйте это явление и его особенности в коллоидных системах по сравнению с истинными растворами.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 6
- •1. Диффузия и ее особенности в коллоидных системах. Уравнение Эйнштейна.
- •2. Лиофильные коллоидные системы. Условия образования и свойства.
- •3. Изобразите изотермы поверхностного натяжения водных растворов метиламина и пропиламина и покажите, как от них можно перейти к изотермам адсорбции. Изобразите изотермы адсорбции этих веществ.
- •4. Как различаются осмотические давления апельсинового сока а) с мякотью, б) без мякоти. Ответ обоснуйте
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А – CaCl2, в - h2so4, с - CaSo4
- •Билет 7
- •1. Изотерма адсорбции Лэнгмюра.
- •2. Устойчивость дисперсных систем. Основы теории длфо.
- •3. Приведите на одном рисунке изотермы поверхностного натяжения пив и пав а)немицеллообразующего , б) мицеллообразующего, в) ионогенного немицеллообразующего.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 8.
- •1. Уравнение адсорбции Гиббса и его естественно-научное и философское значение.
- •2. Диффузионно-седиментационное равновесие и его использование для анализа д исперсных систем.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - k3(Fe(cn)6), в - AgNo3, с - Ag3(Fe(cn)6)
- •6. Изобразите графически изменение ζ-потенциала для золя MnO2 (стабилизатор Na2s2o3) при добавлении к нему электролитов NaCl, AgNo3, kMnO4, Na2s2o3 .
- •Билет 9.
- •1. Зависимость поверхностного натяжения от концентрации пав. Уравнение Шишковского, физический смысл его констант и методы их определения.
- •2. Образование и строение двойного электрического слоя на границе раздела фаз.
- •3. Что Вы знаете о критических эмульсиях и микроэмульсиях?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из рас - творов веществ а и в в случае избытка вещества а или в. А - k2so4, в - Ba(ch3coo)2, с - BaSo4
- •Билет 10.
- •2. Уравнение двухмерного состояния вещества в адсорбционном слое. Основные типы поверхностных пленок.
- •3. Как можно определить важнейшие характеристики молекул пав: площадь поперечного сечения и длину?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na 2SiO3, в - AgNo3, с - Ag2SiO3
5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na2 SiO3, в - hCl, с - h2SiO3
При избытке HCl: { m (H2SiO3) nH+ (n -x)Cl- }х+ хCl-
При избытке Na2SiO3 : { m (H2SiO3 ) nSiO32- 2(n -x)Na+ }2х- 2х Na+
6. Определите тип электролитов: KNO3, NaOH, Cr(NO3)3 по отношению к золю Cr(OН)3 (стабилизатор CrCl3). Проиллюстрируйте графически, как влияет на величину ζ-потенциала добавление к золю растворов Cr(NO3)3, KCl.
KNO3- индеферентный, NaOH- неиндеферентный, Cr(NO3)3 – неиндеферентный
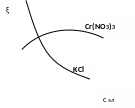
Cr(NO3)3 Если один из ионов электролита способен достраивать кристаллическую решетку коллоидной частицы, то он повышает ζ-потенциал. Находящийся с ним в паре ион, одинаковый по знаку с зарядом противоионов, способен сжимать ДЭС. При малых концентрациях действует первый фактор. При больших концентрациях, когда достройка кристаллической решетки завершена, превалирует второй фак-
тор. Поэтому при введении в систему неиндифферентного электролита
ζ-потенциал сначала будет возрастать, а потом падать, проходя через
максимум. КCl - Увеличивает ионную силу.
Билет 4
1. Смачивание и растекание:
В гетерогенных системах различают два типа межмолекулярного взаимодействия: внутрифазное и межфазное. Притяжение атомов и молекул внутри отдельной фазы называют когезией. Именно она определяет возможность существования веществ в конденсированном состоянии.
К межфазным взаимодействиям относятся понятия адгезии, смачивания и растекания. Адгезия (прилипание) – взаимодействие между приведенными в контакт поверхностями конденсированных фаз разной природы. Адгезия обеспечивается физическими или химическими силами взаимодействия. Смачивание и растекание – это адгезионные взаимодействия между жидким и твердым телом.
Явления адгезии и смачивания широко распространены в природе и технологических процессах: склеивание различных материалов, нанесение лаков, красок, металлических покрытий, печать, крашение тканей, изготовление различных материалов на основе связующих веществ.

Схема, иллюстрирующая понятия когезии (а) и адгезии (б).
Количественные характеристики адгезионных процессов:
Чтобы разорвать столбик жидкости с образованием двух новых поверхностей раздела (см. схему а), необходимо затратить работу, которая равна работе когезии, но противоположна по знаку:
Wразр = –Wк;
Wк = 2σ12.
Изменение энергии Гиббса в этом процессе:
∆Gк = ∆Gкон – ∆Gнач = σ12 + σ12 – 0 = 2σ12;
Wразр = –∆Gк.
Работа, затрачиваемая на разрыв поверхностного слоя на схеме б будет равна работе адгезии с обратным знаком:
Wразр = –Wа = –∆Gа,
где ∆G – изменение энергии Гиббса в процессе разрушения адгезионного слоя.
Изменение энергии Гиббса в этом процессе:
∆Gнач = σ13;
∆Gкон = σ32 + σ12 – σ13;
∆Gа = ∆Gкон – ∆Gнач = σ32 + σ12 – σ13;Wа = σ32 + σ12 – σ13 – уравнение Дюпре.
Закон Юнга. Уравнение, выражающее взаимосвязь работы когезии, поверхностного натяжения и краевого угла смачивания.
Это уравнение называется уравнением Юнга-Дюпре:
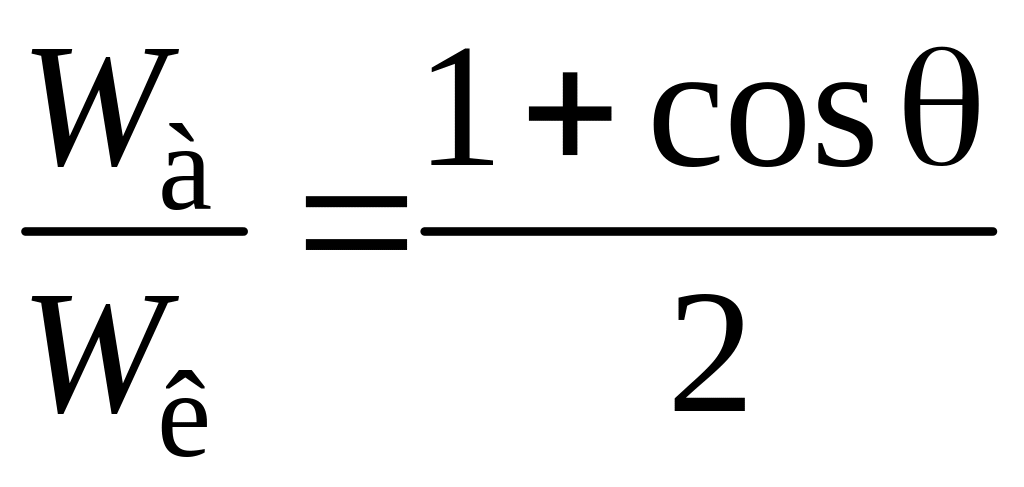 .
.
Оно позволяет выразить термодинамические условия смачивания через соотношения работ когезии и адгезии. Несмачиванию отвечает условие ½Wа < Wк, смачиванию ½Wк < Wа < Wк, растеканию жидкости по твердому телу Wа > Wк закономерности смачивания выполняются не на всех поверхностях, а только на идеально гладких и однородных. Реально же твердые тела всегда имеют неоднородности, от которых зависит краевой угол смачивания, и которые затрудняют определение краевых углов.
