
- •Билет №1
- •1. Конденсационные методы получения лиофобных дисперсных систем.
- •2. Особенности адсорбции ионов и молекул из растворов на твердой поверхности.
- •3. Реология
- •4. Сравните давление насыщенного пара над одинаковыми по размерам каплями воды и пропилового спирта.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - ВеСl2, в - nh4oh, с - Be(oh)2
- •Билет 2
- •1. Диспергационные методы получения лиофобных дисперсных систем.
- •2. Межфазная поверхность, ее силовое поле. Поверхностное натяжение как характеристика этого поля
- •3. Что Вы знаете о структурообразовании в дисперсных системах и типах дисперсных структур?
- •4. Сравните давление насыщенного пара над каплями эквиконцентрированных водных растворов уксусной и масляной кислот (радиусы капель одинаковы). Ответ обоснуйте.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А: k2CrO4, b: AgNo3, c: Ag2CrO4
- •1. Седиментационный анализ суспензий и эмульсий.
- •2. Поверхностная активность. Экспериментальное определение, изменение в гомологических рядах, работа адсорбции.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na2 SiO3, в - hCl, с - h2SiO3
- •Билет 4
- •1. Смачивание и растекание:
- •2 Метод избыточных величин Гиббса и метод слоя конечной толщины
- •3. Дайте определение поверхностной активности и поясните выражение «понятие поверхностной активности относительно». Как экспериментально оценить поверхностную активность?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А (NaCl), в (kh2SbO4), с (NaH2SbO4).
- •Билет 5
- •1. Седиментационный анализ в центробежном поле как метод оценки размеров коллоидных частиц и макромолекул полимеров.
- •2. Адсорбция и ее характеристики. Теории полимолекулярной адсорбции.
- •3. Что такое аэрозоли? Чем обусловлены их специфические свойства и как их разрушают?
- •4. С каким коллоидно-химическим явлением в организме человека связано чувство жажды? Охарактеризуйте это явление и его особенности в коллоидных системах по сравнению с истинными растворами.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 6
- •1. Диффузия и ее особенности в коллоидных системах. Уравнение Эйнштейна.
- •2. Лиофильные коллоидные системы. Условия образования и свойства.
- •3. Изобразите изотермы поверхностного натяжения водных растворов метиламина и пропиламина и покажите, как от них можно перейти к изотермам адсорбции. Изобразите изотермы адсорбции этих веществ.
- •4. Как различаются осмотические давления апельсинового сока а) с мякотью, б) без мякоти. Ответ обоснуйте
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А – CaCl2, в - h2so4, с - CaSo4
- •Билет 7
- •1. Изотерма адсорбции Лэнгмюра.
- •2. Устойчивость дисперсных систем. Основы теории длфо.
- •3. Приведите на одном рисунке изотермы поверхностного натяжения пив и пав а)немицеллообразующего , б) мицеллообразующего, в) ионогенного немицеллообразующего.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - CaCl2, в - h2so4, с - CaSo4
- •Билет 8.
- •1. Уравнение адсорбции Гиббса и его естественно-научное и философское значение.
- •2. Диффузионно-седиментационное равновесие и его использование для анализа д исперсных систем.
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - k3(Fe(cn)6), в - AgNo3, с - Ag3(Fe(cn)6)
- •6. Изобразите графически изменение ζ-потенциала для золя MnO2 (стабилизатор Na2s2o3) при добавлении к нему электролитов NaCl, AgNo3, kMnO4, Na2s2o3 .
- •Билет 9.
- •1. Зависимость поверхностного натяжения от концентрации пав. Уравнение Шишковского, физический смысл его констант и методы их определения.
- •2. Образование и строение двойного электрического слоя на границе раздела фаз.
- •3. Что Вы знаете о критических эмульсиях и микроэмульсиях?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из рас - творов веществ а и в в случае избытка вещества а или в. А - k2so4, в - Ba(ch3coo)2, с - BaSo4
- •Билет 10.
- •2. Уравнение двухмерного состояния вещества в адсорбционном слое. Основные типы поверхностных пленок.
- •3. Как можно определить важнейшие характеристики молекул пав: площадь поперечного сечения и длину?
- •5. Изобразите формулы двух мицелл гидрозоля с, полученного из растворов веществ а и в в случае избытка вещества а или в. А - Na 2SiO3, в - AgNo3, с - Ag2SiO3
Билет №1
1. Конденсационные методы получения лиофобных дисперсных систем.
К лиофобным относятся колл. системы, в которых частицы ДФ слабо взаимодействуют с ДС. Эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Методы получения колл. растворов можно разделить на две группы: методы конденсации и диспергирования (в отд. группу выделяется метод пептизации).
Конденсация – метод получения дисп. систем, в основе которого лежит процесс укрупнения мельчайших частиц ДФ (молекулярных размеров) до частиц с размерами определённого класса дисп. систем.
В-во, находящееся в молекулярно-дисп. состоянии, можно перевести в колл. состояние при замене одного растворителя другим – т.н. методом замены растворителя.
Пример: Канифоль не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется гидрозоль канифоли.
Колл. растворы можно получать также и методом химической конденсации, основанном на проведении хим. реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золотой кислоты формальдегидом:
NaAuO2 + HCOH + Na2CO3 → Au(колл.) + HCOONa + H2O
Золи могут быть получены по реакциям ионного обмена, в результате которых выделяется нерастворимая соль, образующая при определенных условиях коллоидный раствор. Так можно получить золь AgI:
AgNO3 + KI → AgI(золь) + KNO3
Процесс гидролиза различных солей может приводить к образованию коллоидных растворов нерастворимых гидроксидов или кислот. Так получают, например, золь гидроксида железа(III), имеющий следующее строение:
FeCl3 + H2O → {[Fe(OH)3]m · n FeO+ · (n–x)Cl–}x+ · x Cl–
Также лиофобных дисп. системы могут образовываться путём конденсации пересыщенного пара.
2. Особенности адсорбции ионов и молекул из растворов на твердой поверхности.
В зависимости от вида адсорбируемых частиц различают молекулярную и ионную адсорбции.
Р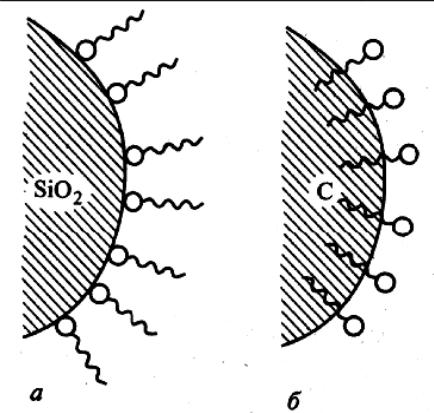 ебиндером
был сформулирован ряд закономерностей:
ебиндером
был сформулирован ряд закономерностей:
В системе полярный адсорбент – неполярный растворитель амфифильные молекулы ориентируются полярной головкой к поверхности адсорбента, а неполярным хвостом – к растворителю. В системе неполярный адсорбент–полярный растворитель ориентация, очевидно, обратная.
На полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей, на неполярных же адсорбентах – неполярные вещества из полярных растворителей.
Чем лучше в данном растворителе растворяется адсорбат, тем он хуже адсорбируется, и наоборот: чем хуже он растворяется – тем лучше адсорбируется.
Если происходит адсорбция из разбавленных растворов, то в гомологических рядах она увеличивается с ростом молекулярной массы адсорбата.
Правило Дюкло – Траубе соблюдается только до определенной длины молекулы, а далее адсорбция может уменьшаться.
Как правило, с увеличением температуры адсорбция уменьшается за исключением того случая, когда вещество плохо растворяется (с увеличением температуры увеличится растворимость а следовательно, и адсорбция).
Процесс адсорбции идет в сторону выравнивания полярностей и тем интенсивнее, чем больше разность полярностей – правило уравнивания полярностей Ребиндера. Полярность адсорбата должна быть промежуточной между полярностью среды и адсорбента.
