- •Основные положения молекулярно-кинетической теории (мкт).
- •Основное уравнения мкт идеального газа. Идеальный газ.
- •Закон о суммарном давлении смеси газов
- •Закон о растворимости компонентов газовой смеси
- •Средняя, наиболее вероятная и среднеквадратичная скорости молекул. Среднеквадратичная скорость движения молекул.
- •Понятие температуры. Абсолютная температурная шкала.
- •Работа газа при различных процессах.
- •Количество теплоты. Теплоемкость вещества.
- •Теплоемкости идеального газа при различных изопроцессах.
- •Первое начало термодинамики.
- •Изохорический процесс. Применение первого начала термодинамики.
- •Изобарический процесс. Применение первого начала термодинамики.
- •Изотермический процесс. Применение первого начала термодинамики.
- •Адиабатический процесс. Применение первого начала термодинамики.
- •Обратимые и необратимые процессы в термодинамических системах. Циклические процессы.
- •Тепловые двигатели. Цикл Карно.
- •Второе и третье начала термодинамики.
- •Формулировка
Изохорический процесс. Применение первого начала термодинамики.
Изохорический или изохорный процесс (от др.-греч. ίσος — «равный», и χώρος — «пространство, занятое место») — это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля не выполняется.
На графиках изображается линиями, которые называются изохоры. Для идеального газа они являются прямыми во всех диаграммах, которые связывают параметры: T (температура), V (объем) и P (давление).
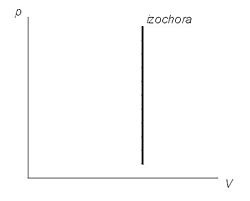
Изохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат, где процесс
1—2 есть изохорное нагревание, а 1—3 —
изохорное охлаждение. При изохорном
процессе газ не совершает работы над
внешними телами, т. е. ![]() Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
![]() т.к.
CV=dUm/dt,
Тогда
для произвольной массы газа получим
т.к.
CV=dUm/dt,
Тогда
для произвольной массы газа получим ![]() (1)
(1)
Изобарический процесс. Применение первого начала термодинамики.
термодинамический процесс, происходящий в системе при постоянном давлении и массе идеального газа.
Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе ![]() .
.
Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔI = ΔU + PΔV.
Диаграмма
этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
(2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний, то
и ![]() откуда
откуда ![]() Тогда
выражение для работы изобарного
расширения примет вид
Тогда
выражение для работы изобарного
расширения примет вид ![]() (3)
(3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.

В
изобарном процессе при сообщении газу
массой m количества теплоты ![]() его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt)
его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt) ![]() При
этом газ совершит работу, определяемую
выражением.
При
этом газ совершит работу, определяемую
выражением.
Изотермический процесс. Применение первого начала термодинамики.
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
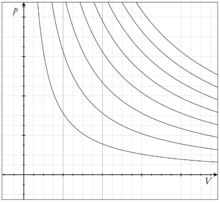
Несколько изотерм для идеального газа нa p-V диаграмме
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
(T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
Диаграмма этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя из формул для работы газа и
уравнения Менделеева-Клайперона найдем
работу изотермического расширения
газа: ![]() Так как при Т=const внутренняя энергия
идеального газа не изменяется:
Так как при Т=const внутренняя энергия
идеального газа не изменяется: ![]() то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса
то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса ![]() т. е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
т. е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
![]() (4)
Значит, для того чтобы при расширении
газа температура не становилась меньше,
к газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
(4)
Значит, для того чтобы при расширении
газа температура не становилась меньше,
к газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.