
- •Основные положения молекулярно-кинетической теории (мкт).
- •Основное уравнения мкт идеального газа. Идеальный газ.
- •Закон о суммарном давлении смеси газов
- •Закон о растворимости компонентов газовой смеси
- •Средняя, наиболее вероятная и среднеквадратичная скорости молекул. Среднеквадратичная скорость движения молекул.
- •Понятие температуры. Абсолютная температурная шкала.
- •Работа газа при различных процессах.
- •Количество теплоты. Теплоемкость вещества.
- •Теплоемкости идеального газа при различных изопроцессах.
- •Первое начало термодинамики.
- •Изохорический процесс. Применение первого начала термодинамики.
- •Изобарический процесс. Применение первого начала термодинамики.
- •Изотермический процесс. Применение первого начала термодинамики.
- •Адиабатический процесс. Применение первого начала термодинамики.
- •Обратимые и необратимые процессы в термодинамических системах. Циклические процессы.
- •Тепловые двигатели. Цикл Карно.
- •Второе и третье начала термодинамики.
- •Формулировка
Основные положения молекулярно-кинетической теории (мкт).
Любое вещество имеет дискретное (прерывистое) строение. Оно состоит из отдельных частиц (молекул, атомов, ионов), разделенных промежутками.
частицы находятся в непрерывном хаотическом движении (тепловом);
Частицы взаимодействуют друг с другом. В процессе их взаимодействия возникают силы притяжения и отталкивания.
Задачей МКТ является не описание движения отдельных частиц, а определение макроскопических параметров системы - таких, как масса, объем, давление, температура и т.п.
Перечислим некоторые явления, подтверждающие правильность исходных идей МКТ: высокая сжимаемость газов наводит на мысль, что расстояния между молекулами весьма велики; газ занимает любой предоставленный ему объем, значит, молекулы движутся независимо друг от друга; диффузия веществ подтверждает предположение о непрерывном хаотическом движении молекул; давление газов на стенки сосуда объясняется ударами молекул о стенки сосуда; броуновское движение является следствием того, что движущиеся молекулы бомбардируют инородные частицы.
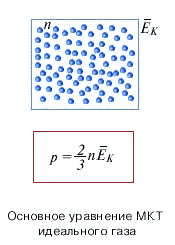
Основное уравнения мкт идеального газа. Идеальный газ.
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
![]() где
р - давление, m0-
масса молекулы, п - концентрация (число
молекул в единице объема), v2-
средний квадрат скорости молекул.
где
р - давление, m0-
масса молекулы, п - концентрация (число
молекул в единице объема), v2-
средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
![]()
![]()
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
 Идеальным
принято считать газ, если:
Идеальным
принято считать газ, если:
а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Уравнение состояния идеального газа.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]() где
где
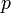 — давление,
— давление,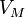 — молярный
объём,
— молярный
объём, — универсальная
газовая постоянная
— универсальная
газовая постоянная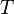 — абсолютная
температура,К.
— абсолютная
температура,К.
Так
как ![]() ,
где
,
где ![]() — количество
вещества, а
— количество
вещества, а ![]() ,
где
,
где ![]() —
масса,
—
масса, ![]() — молярная
масса, уравнение состояния можно
записать:
— молярная
масса, уравнение состояния можно
записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() — закон
Бойля — Мариотта.
— закон
Бойля — Мариотта.
![]() — Закон
Гей-Люссака.
— Закон
Гей-Люссака.
![]() — закон Шарля (второй
закон Гей-Люссака, 1808 г.)
— закон Шарля (второй
закон Гей-Люссака, 1808 г.)
Газовые законы. Закон Дальтона. Изопроцессы.
Вначале были установлены газовые законы, справедливые для постоянной массы данного газа (т.е. m = соnst и М = const ), и, кроме того, одна из оставшихся величин, (Р, V , Т) также поддерживается постоянной.
1. Т = const (изотермический процесс). Взаимосвязь между изменением Р и V выражается законом Бойля-Мариотта Р1 • V1 = Р2 • V2, или Р • V = const . (1)
2. Р = const (изобарический процесс). Взаимосвязь между изменением V и t выражается законом Гей-Люссака V1 = V0• (1+ αt ), (2) где α - коэффициент удельного объемного расширения, равный для всех газов 1/273 град-1. Если это значение подставить в уравнение (2) и температуру выражать в шкале Кельвина, то закон Гей-Люссака запишется так: V1 / T1 = V2 / T2, или V/ Т = const . (3)
3. V = const (изохорический процесс). Взаимосвязь между Р и t выражается законом Шарля P1 = P0( 1 + αt ), где α = 1/273 град-1. В более удобной форме закон Шарля можно записать так: Р1/ T1 = Р2/Т2, или Р/ T = const . (4)
На основе трех частных законов можно легко вывести объединенный газовый закон. Изобразим в координатах p - V две изотермы (рис).
Состояние газа в точке 1 характеризуется параметрами Р1, V1, T1, в точке 2 - Р2, V2, Т2. Перевести систему из точки 1 в точку 2 можно, например, по пути 1-3 (Т = const ) и по пути 3 - 2 (Р = const ) . Состояние газа в точке 3 будет характеризоваться величинами P3 = P2, V3, T3 = T1.
Чтобы установить взаимосвязь между Р1, V1, T1 и Р2, V2, T2, рассмотрим взаимосвязь этих величин с параметрами газа в промежуточной точке 3. Процесс 1-3 - изотермический, поэтому P1V1 = P3V3 или P1V1 = P2V3 и V3 = P1V1/ P2. (5)
Процесс 3-2 - изобарический, поэтому V3 / T3 = V2/ Т2 или V3/ Т1 = V2/ T2 и V3 = V2T1/ Т2. (6)
Приравнивая (5) и (6) и объединяя величины с одинаковыми индексами, получим P1V1/ T1 = P2V2/ T2, или PV / T = cons (7) объединенный газовый закон, из которого легко можно получить частные законы.
Подчеркнем, что объединенный газовый закон, как и частные законы, справедлив только для постоянной массы данного газа.
Законы Дальтона — два физических закона, определяющих суммарное давление и растворимость смеси газов. Сформулированы Джоном Дальтоном в начале XIX века.
