
- •Основные положения молекулярно-кинетической теории (мкт).
- •Основное уравнения мкт идеального газа. Идеальный газ.
- •Закон о суммарном давлении смеси газов
- •Закон о растворимости компонентов газовой смеси
- •Средняя, наиболее вероятная и среднеквадратичная скорости молекул. Среднеквадратичная скорость движения молекул.
- •Понятие температуры. Абсолютная температурная шкала.
- •Работа газа при различных процессах.
- •Количество теплоты. Теплоемкость вещества.
- •Теплоемкости идеального газа при различных изопроцессах.
- •Первое начало термодинамики.
- •Изохорический процесс. Применение первого начала термодинамики.
- •Изобарический процесс. Применение первого начала термодинамики.
- •Изотермический процесс. Применение первого начала термодинамики.
- •Адиабатический процесс. Применение первого начала термодинамики.
- •Обратимые и необратимые процессы в термодинамических системах. Циклические процессы.
- •Тепловые двигатели. Цикл Карно.
- •Второе и третье начала термодинамики.
- •Формулировка
Закон о суммарном давлении смеси газов
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
Закон о растворимости компонентов газовой смеси
![]() При
постоянной температуре растворимость в
данной жидкости каждого из компонентов
газовой смеси,
При
постоянной температуре растворимость в
данной жидкости каждого из компонентов
газовой смеси,
находящейся над жидкостью, пропорциональна их парциальному давлению.
Пределы применимости
Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов эти законы применимы при условии, если их растворимость невелика, а поведение близко к поведению идеального газа.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабата соответственно. Изопроцессы являются частными случаями политропного процесса.
Средняя, наиболее вероятная и среднеквадратичная скорости молекул. Среднеквадратичная скорость движения молекул.
Интересен вопрос о скорости движения молекул газа. В газен царит полный хаос, молекулы движутся по всем направлениям с самыми разными скоростями.
Оказывается, что
в газе есть молекулы с очень маленькими скоростями и с очень большими, но их сравнительно мало.
Средняя проекция скорости на любое направление для всего газа равна 0 (иначе, в газе существовали бы потоки).
Оказывается у молекул есть средняя скорость (по модулю), которая зависит от температуры, и основная часть молекул имеет модуль скорости близкий к ней. Эту скорость мы не можем вычислить, но можем легко посчитать среднеквадратичную скорость движения молекул газа, которая отличается от средней скорости коэффициентом порядка 1.
Определение.
Среднеквадратичная скорость молекул
равна квадратному корню из среднего
квадрата скорости молекул:
![]() (5)
(5)
Вычислим
среднеквадратичную скорость из средней
кинетической энергии молекул, которую
мы легко можем сосчитать:
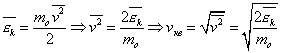 (6)
С учетом уравнения (4) получим:
(6)
С учетом уравнения (4) получим:
![]() (7)
(7)
Понятие температуры. Абсолютная температурная шкала.
Температу́ра — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
В состав производных величин СИ, имеющих специальное название, входит температура Цельсия, измеряемая в градусах Цельсия. На практике часто применяют градусы Цельсия из-за исторической привязки к важным характеристикам воды — температуре таяния льда (0 °C) и температуре кипения (100 °C). Это удобно, так как большинство климатических процессов, процессов в живой природе и т. д. связаны с этим диапазоном. Изменение температуры на один градус Цельсия тождественно изменению температуры на один Кельвин. Поэтому после введения в 1967 г. нового определения Кельвина, температура кипения воды перестала играть роль неизменной реперной точки и, как показывают точные измерения, она уже не равна 100 °C, а близка к 99,975 °C
Абсолютная Температурная Шкала - Термодинамическая температурная шкала или Международная практическая температурная шкала, по которой температура отсчитывается от абсолютного нуля в градусах Кельвина (кельвинах)
Абсолютная температурная шкала была введена, в науку не только для придания газовым законам более удобной фермы. Она имеет глубокий физический смысл. Абсолютная температурная шкала или шкала Кельвина или термодинамическая температурная шкала признана Международным комитетом мер и весов в качестве основной. Определение термодинамической температурной шкалы базируется на втором законе термодинамики и использует цикл Карно. Одним из важнейших свойств термодинамической шкалы является независимость ее от термометрического вещества.
Для определения градуса шкалы используется одна реперная точка - тройная точка воды, а нижней границей температурного промежутка является точка абсолютного нуля. Тройной точке воды присваивается температура 273 15 К точно. Кельвина равен / 273.16 части термодинамической температуры тройной точки воды. Абсолютная температурная шкала имеет нулевую точку при - 273 ( Г 273 О. Абсолютной температурной шкалой называется шкала, в которой за начало отсчета принята точка абсолютного нуля температур. Величина кельвина однозначно определяется требованием, чтобы температура тройной точки воды ( реперная температурная точка, при которой в равновесии существуют жидкая, твердая и газообразная фазы вещества) была равна 273 16 К. Тогда нормальным точкам плавления льда и кипения воды по абсолютной шкале соответствуют температуры 273 15 и 373 15 К, и температурный интервал в 1 К равен температурному интервалу в 1 С. Абсолютной температурной шкалой называют температурную шкалу, которая определяется термодинамическим методом таким образом, что она не зависит от выбора термометрического вещества. Нулевая точка этой шкалы определяется как наинпзшая термодинамически возможная температура. Абсолютная шкала температуры, которая используется в теплофизике в настоящее время, была введена лордом Кельвином ( Вильямом Томсоном) в 1848 г. и поэтому называется также шкалой Кельвина. Существует также абсолютная температурная шкала, которая использует градус шкалы Фаренгейта. Желательность установления абсолютной температурной шкалы, не зависящей от свойств какого-нибудь отдельного вещества, уже была указана в гл. Шкалы Кельвина и Ренкина - абсолютные температурные шкалы, основанные на законах термодинамики и представлении об абсолютном пуле температуры. Абсолютная термодинамическая температурная шкала тождественна эмпирической абсолютной температурной шкале. В связи с этим были предложены две абсолютные температурные шкалы - Кельвина и Ренкина, отличающиеся величиной принятой в них единицы измерения температуры. В начале этой статьи было отмечено, что абсолютная температурная шкала может быть установлена с помощью любого соотношения, основанного на втором законе термодинамики и связывающего температуру Т с другими параметрами состояния. Кроме стоградусной шкалы в науке и технике применяется абсолютная температурная шкала. На основании этих выводов создана температурная шкала, названная абсолютной температурной шкалой.
Внутренняя энергия.
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
 —
подведённая
к телу теплота,
измеренная в джоулях
—
подведённая
к телу теплота,
измеренная в джоулях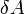 [1] — работа,
совершаемая телом против внешних сил,
измеренная в джоулях
[1] — работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
![]()
где
— температура, измеренная в кельвинах
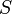 — энтропия,
измеренная в джоулях/кельвин
— энтропия,
измеренная в джоулях/кельвин— давление, измеренное в паскалях
 — химический
потенциал
— химический
потенциал —
количество
частиц в системе
—
количество
частиц в системе
