
- •1. Тепловое излучение. Основные характеристики теплового излучения. Абсолютно черное тело. Закон Кирхгофа
- •2. Законы излучения абсолютно черного тела (Стефана – Больцмана и Вина). Гипотеза и формула Планка для абсолютно черного тела
- •3. Фотоны. Энергия, масса и импульс фотона
- •4. Внешний фотоэффект. Вольтамперная характеристика фотоэффекта. Законы Столетова. Уравнение Эйнштейна
- •5. Давление света
- •6. Комптон – эффект и его объяснение
- •7. Корпускулярно-волновой дуализм материи. Гипотеза де Бройля, ее экспериментальное подтверждение.
- •8. Волны де Бройля. Статистический смысл волн де Бройля, свойства волн.
- •9. Соотношения неопределенностей Гейзенберга, их физическое содержание
- •10. Статистический смысл и свойства волновой функции. Уравнение Шредингера в стационарной форме, смысл входящих величин
- •11. Частица в бесконечно глубокой одномерной потенциальной яме. Квантование энергии частицы. Собственные значения волновой функции
- •14. Туннельный эффект. Коэффициент прозрачности барьера
- •15. Квантово-механический осциллятор
- •16. Модель атома Бора. Постулаты Бора. Спектр излучения атома водорода. Недостатки теории Бора. Опыт Франка – Герца
- •17. Квантовомеханическая теория атома водорода. Уравнение Шредингера для атома водорода, анализ его решения. Собственные значения энергии электрона в атоме. Потенциал ионизации
- •18. Квантование энергии, момента импульса и проекции момента импульса электрона в атоме водорода
- •19. Кратность вырождения уровней энергий. Символика обозначения квантовых состояний
- •20. Магнитные свойства атома. Спин электрона. Орбитальные и спиновые характеристики электрона в атоме. Опыт Штерна – Герлаха
- •21. Полный набор квантовых чисел электронов в атоме, их физический смысл
- •22. Спектр излучения атома водорода. Правила отбора квантовых чисел. Серии излучения атома водорода
- •23. Символика обозначений квантовых состояний. Понятие о вырождении. Принцип Паули. Периодическая система Менделеева
- •26. Молекулы. Энергия молекул. Молекулярные спектры.
- •27. Физические принципы работы лазеров.
- •28. Твердое тело. Образование энергетических зон в твердом теле. Зона проводимости, валентная зона, запрещенная зона. Энергетическая схема твердого тела для металлов, полупроводников, диэлектриков.
- •29. Квантовая модель свободных электронов в металлах. Распределение электронов по энергиям. Уровень Ферми.
- •30. Функция Ферми – Дирака. Энергия Ферми. Понятие вырожденного и невырожденного электронного газа. Условие вырождения.
- •31. Плотность электронных состояний. Заполнение электронами энергетических зон. Энергия и уровень Ферми.
- •32. Элементы квантовой статистики. Нахождение числа электронов в заданном интервале энергий. Нахождение средних значений. Средняя энергия электронов в металле.
- •33. Электрическая проводимость твердых тел с точки зрения зонной теории. Металлы, полупроводники, диэлектрики.
- •34. Чистые полупроводники. Механизм проводимости. Зависимость проводимости от температуры.
- •35. Примесные полупроводники p-типа и n-типа. Механизмы проводимости. Зависимость проводимости от температуры.
- •36. Фотопроводимость полупроводников. Её закономерности.
- •37. Тепловые свойства твердых тел. Экспериментальная зависимость теплоёмкости твёрдых тел от температуры, её объяснение.
- •38. Теплоёмкость твердых тел. Закон Дюлонга – Пти, закон Дебая. Фононы.
- •40. Структура атомных ядер. Характеристики нуклонов. Символическая запись ядер.
- •45. Ядерные реакции, их закономерности. Реакции деления. Реакции синтеза. Энергетический выход реакции.
22. Спектр излучения атома водорода. Правила отбора квантовых чисел. Серии излучения атома водорода
Атом водорода (Z = 1) имеет наиболее простой линейчатый спектр излучения. Частоты спектральных линий для атома водорода и водородоподобных атомов определяются по формуле: v = Rv(1/n2 – 1/n'2), где Rv = Z2me4/8ε02h3 = 3,29 · 1015 с-1 – постоянная Ридберга.
Также эта формула может быть записана через длину волны λ: 1/λ = Rλ(1/n2 – 1/n'2), где Rλ = 1,097 · 107 м-1.
Правила
отбора
–
правила, которые на основе законов
сохранения квантовых чисел устанавливают
допустимые процессы с участием микросистем
(молекул, атомов, ядер, элементарных
частиц). Любая микросистема характеризуется
определённым набором квантовых чисел.
В изолированном состоянии эти квантовые
числа у микросистемы остаются неизменными,
поскольку являются проявлением
соответствующих законов сохранения.
Так электрический заряд или полный
угловой момент
![]() (момент
количества движения) изолированной
системы не изменяются, так как существуют
законы сохранения электрического заряда
и углового момента.
(момент
количества движения) изолированной
системы не изменяются, так как существуют
законы сохранения электрического заряда
и углового момента.
В нагретом до высокой температуры водороде можно наблюдать характерный линейчатый спектр. Все спектральные линии группируются в серии в зависимости от того, на какой энергетический уровень переходят электроны.
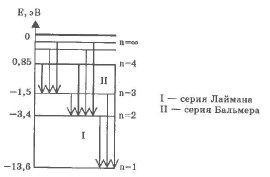
Переходы в первые возбужденные состояния на второй энергетический уровень с верхних уровней образуют серию Бальмера (n = 2), при переходе на первый энергетический уровень с n = 1 образуют серию Лаймана.
23. Символика обозначений квантовых состояний. Понятие о вырождении. Принцип Паули. Периодическая система Менделеева
Для обозначения квантовых состояний с заданным значением орбитального квантового числа l используют следующие спектроскопические символы:
l 0 1 2 3
Обозначение s p q f
подоболочки
Для обозначения квантовых состояний с заданным значением главного квантового числа n используют следующие спектроскопические символы:
n 1 2 3 4
Обозначение K L M N
оболочки
Энергетический уровень квантовой системы называется вырожденным, если содержит более одного состояния. Говоря математически, соответствующее значение энергии является кратным собственным значением оператора гамильтониана.
Количество независимых таких состояний (т.е. кратность собственного значения) называется кратностью вырождения.
Для многоэлектронных атомов выполняется принцип запрета Паули: в одном и том же атоме не может быть двух электронов, обладающих одинаковым набором четырех квантовых чисел.
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от числа протонов в атомном ядре. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
В современном варианте системы предполагается сведение элементов в двухмерную таблицу, в которой каждый столбец (число столбцов составляет 8) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
24. Магнитный момент атома. Атом в магнитном поле. Эффект Зеемана. Магнитный момент, основная величина, характеризующая магнитные свойства вещества. Магнитным моментом обладают элементарные частицы, атомные ядра, электронные оболочки атомов и молекул. Магнитный момент элементарных частиц (электронов, протонов, нейтронов и других), как показала квантовая механика, обусловлен существованием у них собственного механического момента — спина. Механический момент ядер складываются из собственных (спиновых) магнитных моментов, образующих эти ядра протонов и нейтронов, а также магнитный момент, связанных с их орбитальным движением внутри ядра. Магнитный момент электронных оболочек атомов и молекул складываются из спиновых и орбитальных магнитных моментов электронов.
При внесении атома
в магнитное поле с индукцией B
на электрон, движущийся по орбите,
эквивалентной замкнутому контуру с
током, действует момент сил M:
![]() ,
при этом изменяется орбитальный момент
импульса электрона:
,
при этом изменяется орбитальный момент
импульса электрона:![]() ,
,
аналогично изменяется
вектор орбитального магнитного момента
электрона:
![]() ,
из этого следует, что векторы Le
и Pm
, и сама орбита прецессирует вокруг
направления вектора B.
Эта прецессия называется ларморовской
прецессией. Угловая скорость этой
прецессии ωL
зависит только от индукции магнитного
поля и совпадает с ней по направлению.
,
из этого следует, что векторы Le
и Pm
, и сама орбита прецессирует вокруг
направления вектора B.
Эта прецессия называется ларморовской
прецессией. Угловая скорость этой
прецессии ωL
зависит только от индукции магнитного
поля и совпадает с ней по направлению.
![]()
Эффектом Зеемана называют расщепление энергетических уровней атома под действием магнитного поля. Следствием расщепления уровней является расщепление спектральных линий в атомных спектрах излучения и поглощения.
25. Рентгеновское излучение. Тормозное и характеристическое излучение. Закон Мозли. Рентгеновское излучение — электромагнитные волны, энергия фотонов которых лежит на энергетической шкале между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн от 10−4 до 10² Å (от 10−14 до 10−8 м).
Тормозное излучение возникает при торможении электронов антикатодом рентгеновской трубки. Оно разлагается в сплошной спектр, имеющий резкую границу со стороны малых длин волн. Положение этой границы определяется энергией падающих на вещество электронов и не зависит от природы вещества.
Характеристические рентгеновские лучи образуются при выбивании электрона одного из внутренних слоёв атома с последующим переходом на освободившуюся орбиту электрона с какого-либо внешнего слоя. Они обладают линейчатым спектром, аналогичным оптическим спектрам газов.
Закон Мозли -
закон, связывающий частоту спектральных
линий характеристического рентгеновского
излучения химического элемента с его
порядковым номером. Согласно Закону
Мозли, корень квадратный из частоты n
спектральной линии характеристического
излучения элемента есть линейная функция
его порядкового номера Z:
![]() ,
где R — постоянная Ридберга, Sn
— постоянная экранирования, n — главное
квантовое число.
,
где R — постоянная Ридберга, Sn
— постоянная экранирования, n — главное
квантовое число.
