
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Получение алканов
- •2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании:
- •4. Гидролиз карбидов
- •5. Декарбоксилирование солей низших карбоновых кислот
- •Химические свойства алканов
- •2. Нитрование (реакция Коновалова)- реакция радикального замещения sr.
- •3. Реакции дегидрирования
- •5. Реакции горения
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Крекинг и пиролиз нефтепродуктов.
- •2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании :
- •Химические свойства алкенов.
- •2. Реакции полимеризации:
- •3. Реакции окисления
- •Решение:
- •1) Условию задачи отвечает следующее строение:
- •Задачи и упражнения для самостоятельного решения
- •97. Смесь этена с бутаном, с плотность по водороду 21,5, сожгли. Продукты сгорания 20 л этой смеси пропустили через избыток раствора гидроксида кальция. Определите массу выпавшего осадка.
- •Диеновые углеводороды
- •1. Галогенирование
- •4. Полимеризация.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Алкины.
- •2. Взаимодействие карбидов металлов с водой
- •4. Дегидрогалогенирование дигалогеналканов:
- •5. Из галогеналканов под действием цинка:
- •Химические свойства алкинов
- •1. Галогенирование
- •3. Гидратация.
- •4. Гидрирование.
- •6. Кислотные свойства алкинов
- •8. Горение
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Циклоалканы
- •Получение циклоалканов
- •2. Циклогексан и его производные получают гидрированием бензола:
- •Химические свойства циклоалканов
- •Примеры решения задач Пример 18.
- •Решение:
- •Пример 19.
- •Решение:
- •Пример 20.
- •Задачи и упражнения для самостоятельного решения
- •Получение аренов
- •Химические свойства аренов
- •1. Электрофильное замещение в бензольном кольце
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Гидролиз алкилгалогенидов в кислой или щелочной среде:
- •3. Гидролиз сложных эфиров:
- •4. Восстановление более высокоокисленных соединений
- •5. Биохимические методы.
- •1. Кислотные свойства.
- •3. Дегидратация(отщепление воды).
- •5. Окисление спиртов
- •1. Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов. Отличия:
- •Задачи и упражнения для самостоятельного решения
- •1. Кислотные свойства
- •2. Реакции электрофильного замещения в бензольном кольце
- •3. Окислительно-восстановительные реакции
- •4. Реакции комплексообразования
- •Задачи и упражнения для самостоятельного решения
- •Карбонильные соединения
- •Получение карбонильных соединений
- •1. Окисление спиртов
- •4. Гидратация алкинов(реакция Кучерова).
- •5. Получение ацетона в промышленности
- •Химические свойства карбонильных соединений
- •1. Окисление
- •2. Восстановление.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Карбоновые кислоты
- •1. Растворимые кислоты диссоциируют в воде:
- •2. Карбоновые кислоты (особенно растворимые в воде)
- •9. Окисление
- •11. Реакции в бензольном ядре ароматических кислот
- •12. Реакции ненасыщенных кислот
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Сложные эфиры. Жиры.
- •2. Взаимодействие ангидрида карбоновой кислоты со спиртом
- •3. Взаимодействие хлорангидрида карбоновой кислоты со спиртом
- •Углеводы
- •1. Окисление
- •3. Алкилирование аминов:
- •4. Взаимодействие с ангидридами и хлорангидридами
- •7. Особенности ароматических аминов(анилина)
- •8. Окисление анилина
- •2. Обработка галогенсодержащих карбоновых кислот избытком аммиака:
- •3. Реакции, обусловленные наличием двух функциональных групп в
Получение алканов
1. Основной источник углеводородов - природные газы и нефть. В промышленности углеводороды получают перегонкой
нефтепродуктов.
2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании:
СН2=СН2
+ Н2
 С2Н6
; СН3
– С ≡ СН + 2 Н2
С3Н8
С2Н6
; СН3
– С ≡ СН + 2 Н2
С3Н8
3. По реакции Вюрца, действуя натрием на галогеналканы при нагревании
CH3-CH2Cl + ClCH2-CH3 + 2 Na CH3- CH2-CH2 - CH3 + 2 NaCl
бутан
2 CH3- CH-CH3 + 2 Na CH3- CH-CH3 + 2 NaCl
| |
Br CH3- CH-CH3
2,3-диметилбутан
Cl CH3
| |
CH3-Cl + CH3- CH-CH3 + 2 Na CH3- CH-CH3 + 2 NaCl
изобутан
4. Гидролиз карбидов
Al4C3 + 12 H2 O = 4 Al(OH)3 + 3 CH4 ↑
Be2C + 4 H2 O = 2 Be(OH)2 + CH4 ↑
5. Декарбоксилирование солей низших карбоновых кислот
(для газообразных углеводородов)
t0
CH3COONa + NaOH Na2CO3 + CH4↑
тв тв
t0
CH3 CH 2COOK + KOH K2CO3 + C 2H6↑
тв тв
Химические свойства алканов
1. Галогенирование – реакция радикального замещения (SR)атомов
водорода на галогены.
а) Инициирование– образование свободных радикалов
Молекулы хлора поглощают свет и диссоциируют на атомы:
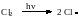
б) Рост цепи
Атом хлора может отнимать атом водорода у молекулы алкана с образованием хлороводорода и алкильного радикала:

Алкильный радикал атакует молекулу хлора,образуя молекулу алкилгалогенида и атом хлоа, который способен начать следующую стадию этой цепной реакции
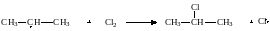
в) Обрыв цепи
Обрыв
цепи происходит при взаимодействии
каких-либо двух имеющихся в смеси
радикалов:
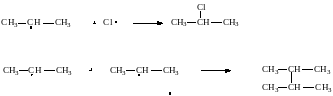
Вообще получить по этому методу монозамещённые продукты практически невозможно, так как образующиеся алкилгалогениды взаимодействуют дальше с атомами хлора. На ярком свету реакция протекает очень бурно(со взрывом).
Устойчивость свободных радикалов уменьшается в следующем ряду:
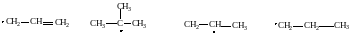
аллил третбутил изопропил пропил
Поэтому основным продуктом радикального замещения в реакциях галогенирования алканов являются соединения, в которых атом галогена связан с аллильным или третичным атомом углерода. Гораздо меньше продуктов замещения по вторичному и первичному атомам углерода.
Бромирование протекает менее энергично, взаимодействие с иодом осуществить практически не удаётся, наоборот, фтор взаимодействует с алканами со взрывом.
При бромировании преобладают соединения, в которых атом брома связан с третичным атомом углерода. При хлорировании образуется сложная смесь, в которых атом хлора связан с третичным, вторичным и первичным
атомами углерода.
һ ν
СН3-СН2-СН-СН3 + Br2 СH3-CH2 –CBr -CH3 + HBr +
| |
CH3 CH3
2-метилбутан 2-бром-2-метилбутан
(основной продукт)
CH3 – CH – CH – CH3
| |
Br CH3
2- бром- 3- метилбутан
(побочный продукт)
В
молекуле алкана могут замещаться один
или несколько атомов водорода
СН3-СН2-СН3
+ Cl2
 СН3-СН-СН3
+ HCl
СН3-СН-СН3
+ HCl
|
Cl
Cl
|
СН3-СН2-СН3 + 2 Cl2 СН3-С-СН3 + 2 HCl
|
Cl
Cl
|
СН3-СН2-СН3 + 3 Cl2 СH2-С-СН3 + 3 HCl
| |
Cl Cl
При этом образуется смесь галогенпроизводных.
