
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Получение алканов
- •2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании:
- •4. Гидролиз карбидов
- •5. Декарбоксилирование солей низших карбоновых кислот
- •Химические свойства алканов
- •2. Нитрование (реакция Коновалова)- реакция радикального замещения sr.
- •3. Реакции дегидрирования
- •5. Реакции горения
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Крекинг и пиролиз нефтепродуктов.
- •2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании :
- •Химические свойства алкенов.
- •2. Реакции полимеризации:
- •3. Реакции окисления
- •Решение:
- •1) Условию задачи отвечает следующее строение:
- •Задачи и упражнения для самостоятельного решения
- •97. Смесь этена с бутаном, с плотность по водороду 21,5, сожгли. Продукты сгорания 20 л этой смеси пропустили через избыток раствора гидроксида кальция. Определите массу выпавшего осадка.
- •Диеновые углеводороды
- •1. Галогенирование
- •4. Полимеризация.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Алкины.
- •2. Взаимодействие карбидов металлов с водой
- •4. Дегидрогалогенирование дигалогеналканов:
- •5. Из галогеналканов под действием цинка:
- •Химические свойства алкинов
- •1. Галогенирование
- •3. Гидратация.
- •4. Гидрирование.
- •6. Кислотные свойства алкинов
- •8. Горение
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Циклоалканы
- •Получение циклоалканов
- •2. Циклогексан и его производные получают гидрированием бензола:
- •Химические свойства циклоалканов
- •Примеры решения задач Пример 18.
- •Решение:
- •Пример 19.
- •Решение:
- •Пример 20.
- •Задачи и упражнения для самостоятельного решения
- •Получение аренов
- •Химические свойства аренов
- •1. Электрофильное замещение в бензольном кольце
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Гидролиз алкилгалогенидов в кислой или щелочной среде:
- •3. Гидролиз сложных эфиров:
- •4. Восстановление более высокоокисленных соединений
- •5. Биохимические методы.
- •1. Кислотные свойства.
- •3. Дегидратация(отщепление воды).
- •5. Окисление спиртов
- •1. Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов. Отличия:
- •Задачи и упражнения для самостоятельного решения
- •1. Кислотные свойства
- •2. Реакции электрофильного замещения в бензольном кольце
- •3. Окислительно-восстановительные реакции
- •4. Реакции комплексообразования
- •Задачи и упражнения для самостоятельного решения
- •Карбонильные соединения
- •Получение карбонильных соединений
- •1. Окисление спиртов
- •4. Гидратация алкинов(реакция Кучерова).
- •5. Получение ацетона в промышленности
- •Химические свойства карбонильных соединений
- •1. Окисление
- •2. Восстановление.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Карбоновые кислоты
- •1. Растворимые кислоты диссоциируют в воде:
- •2. Карбоновые кислоты (особенно растворимые в воде)
- •9. Окисление
- •11. Реакции в бензольном ядре ароматических кислот
- •12. Реакции ненасыщенных кислот
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Сложные эфиры. Жиры.
- •2. Взаимодействие ангидрида карбоновой кислоты со спиртом
- •3. Взаимодействие хлорангидрида карбоновой кислоты со спиртом
- •Углеводы
- •1. Окисление
- •3. Алкилирование аминов:
- •4. Взаимодействие с ангидридами и хлорангидридами
- •7. Особенности ароматических аминов(анилина)
- •8. Окисление анилина
- •2. Обработка галогенсодержащих карбоновых кислот избытком аммиака:
- •3. Реакции, обусловленные наличием двух функциональных групп в
4. Гидратация алкинов(реакция Кучерова).
Реакции присоединения воды в присутствии солей Hg2+ . Из ацетилена образуется ацетальдегид, из гомологов ацетилена образуются кетоны.
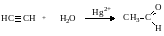
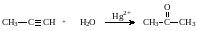
5. Получение ацетона в промышленности
- при кумольном методе получения фенола.

6. Ацилирование ароматических соединений по Фриделю-Крафтсу
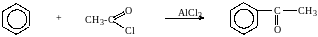
кетон
Химические свойства карбонильных соединений
1. Окисление
а) Реакция «серебряного зеркала».
Альдегиды легко окисляются до кислот при реакции с гидроксидом диаммин серебра(аммиачным раствором оксида серебра). Кетоны окисляются очень трудно, только сильными окислителями с разрывом связи.
R-CH=O +2[Ag(NH3)2]OH R-COONH4 + 2Ag↓ +3NH3 + H2O
Формальдегид избытком аммиачного раствора оксида серебра окисляется до угольной кислоты, которая в аммиачной среде образует карбонат аммония.
H-CH=O + 4[Ag(NH3)2]OH (NH4)2CO3 + 4Ag↓ + 6NH3 + 2H2O
В упрощённом виде:
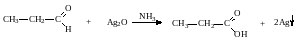
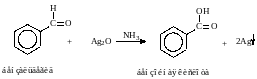
Реакция «серебряного зеркала» является качественной реакцией на карбонильную группу.
б) Окисление гидроксидом меди(II)
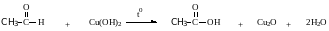
В результате этой реакции образуется осадок Cu2O красно-кирпичного цвета. Эта реакция также является качественной на альдегиды.
Кетоны окисляются очень трудно, только сильными окислителями с разрывом связи.
2. Восстановление.
Альдегиды восстанавливаются до первичных спиртов, кетоны до вторичных спиртов.
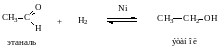
ю
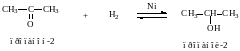
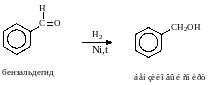
3. Взаимодействие со спиртами -
образование полуацеталей и ацеталей.
Эта реакция имеет значение в образовании углеводов в циклических формах. ( и - аномеры)
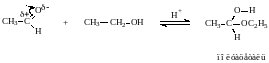
При избытке спирта образуется полный ацеталь.
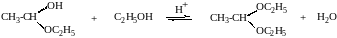
диацеталь уксусного альдегида
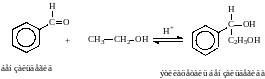
4. Гидратация
Формальдегид в водном растворе гидратирован практически полностью, ацетальдегид – примерно на 50% ,высшие альдегиды и кетоны почти не гидратируются.
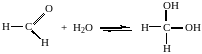
5. Взаимодействие с галогенами.
Атом водорода при втором углеродном атоме углеводородной цепи обладает повышенной подвижностью, так как карбонильная группа смещает на себя электронную плотность Поэтому при взаимодействии альдегидов с хлором или бромом атом водорода замещается на галоген.

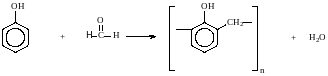
6. Реакции поликонденсации.
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит поликонденсация с образованием высокомолекулярного соединения формальдегидной смолы.
7. Особенности бензальдегида.
Так как в бензальдегиде есть ароматическое ядро, то может идти реакция замещения водорода, в 3,5 – положении бензольного кольца, так как карбонильная группа стягивает на себя электронную плотность.
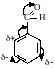
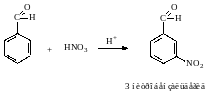
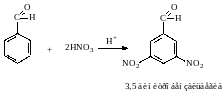
Примеры решения задач
Пример 29. При взаимодействии 13,8г этанола с 34г оксида меди(II) был получен альдегид, масса которого составила 9,24г. Рассчитать выход альдегида.
Решение:
1) Напишем соответствующее уравнение реакции
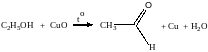
2) Находим количества веществ этанола и оксида меди:
n(C2H5OH) = m(C2H5OH) / M(C2H5OH)=13,8 / 46 = 0,3( моль )
n(CuO) = m(CuO) / M(CuO) = 34 / 80 = 0,425(моль)
3) Согласно уравнению реакции спирт взаимодействует с оксидом меди в молярном соотношении 1:1. Но так как на 0,3 моль спирта приходится 0,425 моль оксида меди, то этанол находится в недостатке, и при 100% выходе из 0,3 моль этанола может образоваться 0,3 моль этаналя.
4) Масса этаналя который может образоваться теоретически:
m(CH3CHO) = n(CH3CHO) ∙ M(CH3CHO) = 0,3 ∙ 44 = 13,2(г )
5) Тогда выход альдегида равен: ŋ = m(практ.)/ m(теор.) = 9,24 /13,2= 70%
Ответ: 70%
Пример30. При действии на смесь карбида кальция и карбоната кальция избытком соляной кислоты образовалась смесь газов с плотностью по озону D(O3) = 0,8042. Какое количество метаналя можно получить из 108,375 г этой смеси?
Решение:
1) Напишем соответствующие уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑
CaCO3 + 2HCl = CaCl2 +H2O + CO2↑
2) Рассчитываем среднюю молярную массу газовой смеси
M ср(газ.см.) = D(O3)∙M(O3) = 0,8042∙48 = 38,6(г/моль)
3) Находим количество вещества газовой смеси:
n(газ см.) = m(газ см.) / Мср(газ см.) = 108,375 / 38,6 = 2,81 (моль)
4) Пусть в газовой смеси количество вещества ацетилена – х , тогда
количество вещества углекислого газа будет равно (2,81 – x).
5) Тогда масса газовой смеси равна: 108,375 = 26x + 44∙( 2,81 – x )
Откуда х = 0,85 ( моль)
6) Исходя из уравнения реакции гидратации ацетилена
С2Н2+ Н2О = СН3СНО из 0,85моль ацетилена можно получить 0,85моль ацетальдегида. Масса альдегида равна 0,85 ∙ 44 = 37,4 (г)
Ответ: m(ацетальдегида) = 37,4г
Пример31. Рассчитать массу ацетата аммония, которая образуется при обработке 110 г 20% водного раствора ацетальдегида избытком аммиачного раствора оксида серебра.
Решение:
1) Напишем уравнение реакции
CH3CHO + Ag2O(NH3) = CH3COONH4 + 2Ag
2) Масса ацетальдегида в растворе равна:
m(CH3CHO) = ω ∙ m(р-ра) = 0,2 ∙110= 22(г)
3) Находим количество вещества ацетальдегида:
n(CH3CHO) = m(CH3CHO) / M(CH3CHO) = 22 / 44 = 0,5 ( моль)
4) Согласно уравнению из 0,5 моль ацетальдегида образуется
0,5 моль ацетата аммония.
Тогда масса ацетата аммония равна:
m(ацетата аммония) = n ∙ M = 0,5 ∙ 77 = 38,5 (г)
Ответ: m(ацетата аммония) = 38,5г
