
[Править]Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество
Раскаленный магний реагирует с водой: Mg (раск.) + Н2О = MgO + H2↑; Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода: Mg + 2HCl = MgCl2 + H2; При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида: 2Mg + О2 = 2MgO; 3Mg + N2 = Mg3N2
Соединения магния. Для аналитической химии магния имеют значение его труднорастворимые и особенно внутрикомплексные (бесцветные, окрашенные или флуорисцирующие) соединения. Поляризующая способность иона Mg2+ невысокая, а по величине кэффициента поляризации, характеризующего количественно деформируемость иона, магний уступает большинству металлов. Поэтому комплексные соединения магния сравнительно малоустойчивы и образуются, как правило, только в щелочной среде. Тем не менее, они имеют чрезвычайно важное значение для аналитической химии магния. Меньшая устойчивость некоторых комплексных соединений магния, по сравнению с комплексами других металлов, иногда используется для маскирования последних при определении магния титриметрическими, фотометрическими и другими методами.
42. Общая характеристика s-элементов
К s-элементам относятся элементы главных подгрупп I и II
групп. Их электронные структуры имеют вид
[инертн. газ]ns1, [инертн. газ]ns2.419
Внешние электроны этих элементов удерживаются слабо и
легко отдаются в химических реакциях, вследствие чего s-элементы
легко образуют катионы. При взаимодействии катиона и аниона
надо учитывать поляризационное взаимодействие. Роль внешнего
электрического поля играет один ион по отношению к другому.
Чаще всего поляризуется анион, так как катион имеет устойчивую
оболочку инертного газа. Для чисто ионной молекулы центры
положительного и отрицательного зарядов совпадают с зарядами
ядер, и межъядерное расстояние равно расстоянию между
полюсами диполя: l = d. При поляризации происходит смещение
зарядов. Катион как бы притягивает электроны к себе, и центр
тяжести отрицательного заряда смещается (l < d). Таким образом,
полярность уменьшается, следовательно, уменьшается и ионность,
а ковалентность связи увеличивается.
S-элементы первой группы обладают слабым поляризующим
действием, и их соединения обладают преимущественно ионным
типом связи. Для s-элементов II группы поляризующее действие
катионов возрастает.
S-металлы I и II групп растворяются в жидком аммиаке с
образованием голубых (при малой концентрации) растворов,
обладающих высокой электропроводностью. Главными
переносчиками тока здесь являются сольватированные электроны,
т. е. в растворах наблюдается следующее равновесие:
Me (тв) → Me (тв. в раств) → Me+ + ē.2 ē ↔ ē2
С увеличением концентрации натрия уменьшаются
парамагнитные свойства растворов.
Связан электрон с аммиаком или с сольватированным ионом
металла, еще не до конца выяснено. Предполагается, что, кроме
сольватированного электрона, в растворе существуют
отрицательные ионы (стабилизированные сольватацией):
M+ + 2L-→ M- + 2L,
где L – растворитель; L- – сольватированный электрон
общая распространенность элемента зависит
от свойств его атомного ядра, а характер
распространения – от свойств наружной электронной
оболочки его атома.
41.
При электролизе водных растворов бескислородных кислот и их солей (кроме НF и фторидов) у анода разряжаются анионы, например:
2Cl- - 2e = Cl2
2Br- - 2e = Br2
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Классификация анодных процессов. На основании высказанных соображений А.Д.Шатаев предлагает следующую классификацию анодных процессов: а) Образование на аноде растворимых продуктов. 1) ионизация металла с образованием простых ионов.
2) ионизация металла с образованием комплексных ионов за счет присутствующих в растворе анионов.
3) ионизация металла с образованием комплексных ионов с ионами гидрооксидов.
4) повышение положительной валентности ионов металла.
5) понижение отрицательной валентности комплексного аниона.
б) Образование на аноде недорастворимых продуктов. 1) образование на аноде гидрооксидов металла.
2) образование на аноде труднорастворимых нейтральных солей.
3) Образование на аноде основных солей.
4) Образование на аноде оксидов металла (анодное оксидированние).
в) Анодное выделение кислорода.
40.
Электролиз расплава соли с использованием
инертных электродов показан на следующей
схеме:
Анод![]() При
высоких температурах расплав соли
диссоциирует на ионы:
При
высоких температурах расплав соли
диссоциирует на ионы:
![]() .
Прохождение
электрического тока через расплав
обусловлено тремя одновременно
протекающими процессами:
направленное
движение катионов Мg2+ к катоду, а анионов
Cl- - к аноду;
восстановление,
происходящее на катоде:
.
Прохождение
электрического тока через расплав
обусловлено тремя одновременно
протекающими процессами:
направленное
движение катионов Мg2+ к катоду, а анионов
Cl- - к аноду;
восстановление,
происходящее на катоде:
![]() окисление,
происходящее на аноде:
окисление,
происходящее на аноде:
![]() Суммарное
уравнение электролиза после уравнивания
числа отдаваемых и присоединенных
электронов принимает вид:
Суммарное
уравнение электролиза после уравнивания
числа отдаваемых и присоединенных
электронов принимает вид:
![]() Схематически
весь процесс можно представить следующим
образом:
Схематически
весь процесс можно представить следующим
образом:
![]()
![]()
![]()
![]() Катод
(-) Анод ( + )
Mg2+
2Cl-
Катод
(-) Анод ( + )
Mg2+
2Cl-
![]() Mg2+
+ 2e- = Mg 2Cl- - 2e- = Cl2
Mg2+
+ 2e- = Mg 2Cl- - 2e- = Cl2
![]() Электролиз
растворов электролитов
Электролиз
растворов электролитов более сложен
из-за возможности участия в электродных
процессах молекул воды в восстановлении
на катоде:
Электролиз
растворов электролитов
Электролиз
растворов электролитов более сложен
из-за возможности участия в электродных
процессах молекул воды в восстановлении
на катоде:
![]() и
окислении на аноде:
и
окислении на аноде:
![]()
![]() .
В
тех случаях, когда на одном и том же
электроде возможно протекание двух или
большего числа процессов, наиболее
вероятен тот, осуществление которого
связано с минимальной затратой энергии.
Это означает, что на катоде восстанавливаются
в первую очередь окисленные формы
окислительно-восстановительных систем
с наибольшим электродным потенциалом,
а на аноде окисляются восстановленные
формы с наименьшим электродным
потенциалом.
Для
определения порядка протекания
окислительно-восстановительных процессов
на электродах при электролизе водных
растворов можно руководствоваться
следующими практическими правилами.
Катод.
В
первую очередь восстанавливаются
катионы металлов, имеющих стандартный
электродный потенциал больший, чем у
водорода, в порядке уменьшения Ео.
Катионы
металлов с малым стандартным электродным
потенциалом (от Li+ до Al3+ включительно)
не восстанавливаются, а вместо них
восстанавливаются молекулы воды (в
кислой среде – ионы Н+).
Катионы
металлов, имеющих стандартный электродный
потенциал меньший, чем у водорода, но
больший, чем у алюминия, восстанавливаются
одновременно с молекулами
воды.
Анод.
Характер
окислительных процессов зависит также
от материала электродов. Различают
нерастворимые (инертные) и растворимые
(активные) электроды.
Инертные
электроды изготавливаются обычно из
графита, угля, платины; в процессе
электролиза они химически не изменяются,
а служат лишь для передачи электронов
во внешнюю цель.
При
использовании инертных анодов следует
учитывать следующее:
В
первую очередь окисляются простые
анионы в порядке возрастания их Ео, не
превышающих + 1,5 В (S2-, J-, Br-, Cl-).
При
электролизе водных растворов, содержащих
анионы кислородосодержащих кислот
(CO32-, NO3-, SO42-, PO43- и др.), на аноде окисляются
не эти анионы, а молекулы воды.
В
щелочных растворах на аноде окисляются
ионы ОН-:
.
В
тех случаях, когда на одном и том же
электроде возможно протекание двух или
большего числа процессов, наиболее
вероятен тот, осуществление которого
связано с минимальной затратой энергии.
Это означает, что на катоде восстанавливаются
в первую очередь окисленные формы
окислительно-восстановительных систем
с наибольшим электродным потенциалом,
а на аноде окисляются восстановленные
формы с наименьшим электродным
потенциалом.
Для
определения порядка протекания
окислительно-восстановительных процессов
на электродах при электролизе водных
растворов можно руководствоваться
следующими практическими правилами.
Катод.
В
первую очередь восстанавливаются
катионы металлов, имеющих стандартный
электродный потенциал больший, чем у
водорода, в порядке уменьшения Ео.
Катионы
металлов с малым стандартным электродным
потенциалом (от Li+ до Al3+ включительно)
не восстанавливаются, а вместо них
восстанавливаются молекулы воды (в
кислой среде – ионы Н+).
Катионы
металлов, имеющих стандартный электродный
потенциал меньший, чем у водорода, но
больший, чем у алюминия, восстанавливаются
одновременно с молекулами
воды.
Анод.
Характер
окислительных процессов зависит также
от материала электродов. Различают
нерастворимые (инертные) и растворимые
(активные) электроды.
Инертные
электроды изготавливаются обычно из
графита, угля, платины; в процессе
электролиза они химически не изменяются,
а служат лишь для передачи электронов
во внешнюю цель.
При
использовании инертных анодов следует
учитывать следующее:
В
первую очередь окисляются простые
анионы в порядке возрастания их Ео, не
превышающих + 1,5 В (S2-, J-, Br-, Cl-).
При
электролизе водных растворов, содержащих
анионы кислородосодержащих кислот
(CO32-, NO3-, SO42-, PO43- и др.), на аноде окисляются
не эти анионы, а молекулы воды.
В
щелочных растворах на аноде окисляются
ионы ОН-:
![]() При
использовании растворимых анодов (из
Cu, Zn, Ag, Ni и др. металлов) электроны во
внешнюю цель посылает сам анод за счет
окисления атомов металла, из которого
сделан анод:
При
использовании растворимых анодов (из
Cu, Zn, Ag, Ni и др. металлов) электроны во
внешнюю цель посылает сам анод за счет
окисления атомов металла, из которого
сделан анод:
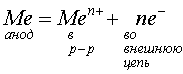 .
Рассмотрим
конкретные примеры.
Электролиз
водных растворов солей (инертные
электроды)
.
Рассмотрим
конкретные примеры.
Электролиз
водных растворов солей (инертные
электроды)
![]() 1)
1) ![]()
![]()
![]() (
- ) Катод Анод ( + )
Na+,
Н2О Cl-, H2O
(
- ) Катод Анод ( + )
Na+,
Н2О Cl-, H2O
![]()
![]()
![]()
![]()
![]() 2)
2) ![]()
![]() (
- ) Катод Анод ( + )
4К+,
4Н2О SO42-, Н2О
(
- ) Катод Анод ( + )
4К+,
4Н2О SO42-, Н2О
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3)
3) ![]() (
- ) Катод Анод (
+ )
Zn2+,
H2O SO42-, H2O
(
- ) Катод Анод (
+ )
Zn2+,
H2O SO42-, H2O
![]()
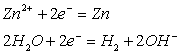
![]()
![]()
![]()
![]() 4)
Электролиз водного раствора CuCl2 (активный
медный анод)
4)
Электролиз водного раствора CuCl2 (активный
медный анод)
![]()
![]()
![]() (
- ) Катод Анод ( + )
Cu2+,
H2O 2Cl-, H2O
(
- ) Катод Анод ( + )
Cu2+,
H2O 2Cl-, H2O
![]()
![]()
![]()
![]()
![]() Количественные
характеристики электролитических
процессов устанавливаются двумя законами
Фарадея:
Масса
веществ, выделившихся на электродах
при электролизе, прямо пропорциональна
количеству электричества, прошедшего
через раствор или расплав электролита.
При
пропускании одинакового количества
электричества через растворы или
расплавы различных элементов масса
веществ, выделяющихся на электродах,
пропорциональна молярным массам их
эквивалентов.
Экспериментально
установлено, что для выделения на
электроде одной молярной массы эквивалента
вещества необходимо затратить одно и
то же количество электричества, равное
~96500 Кл. Оно получило название постоянной
Фарадея F.
Оба
закона можно объединить общей
формулой:
Количественные
характеристики электролитических
процессов устанавливаются двумя законами
Фарадея:
Масса
веществ, выделившихся на электродах
при электролизе, прямо пропорциональна
количеству электричества, прошедшего
через раствор или расплав электролита.
При
пропускании одинакового количества
электричества через растворы или
расплавы различных элементов масса
веществ, выделяющихся на электродах,
пропорциональна молярным массам их
эквивалентов.
Экспериментально
установлено, что для выделения на
электроде одной молярной массы эквивалента
вещества необходимо затратить одно и
то же количество электричества, равное
~96500 Кл. Оно получило название постоянной
Фарадея F.
Оба
закона можно объединить общей
формулой:
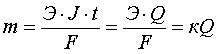 ,
где
m – масса окисленного или восстановленного
вещества, г; Э – молярная масса его
эквивалента, г/моль; Q – количество
электричества, прошедшее через элемент
(Q = Jt, где J – сила тока, А; t – время,
с).
Если
Q = Jt = 1 Кл, то
,
где
m – масса окисленного или восстановленного
вещества, г; Э – молярная масса его
эквивалента, г/моль; Q – количество
электричества, прошедшее через элемент
(Q = Jt, где J – сила тока, А; t – время,
с).
Если
Q = Jt = 1 Кл, то
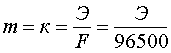 .
Величина
К называется электрохимическим
эквивалентом вещества. Она представляет
собой массу вещества, окисляющегося
или восстанавливающегося на электродах
при прохождении через элемент 1 Кл
электричества. Видно, что химический
эквивалент связан с электрохимическим
эквивалентом соотношением:
.
Величина
К называется электрохимическим
эквивалентом вещества. Она представляет
собой массу вещества, окисляющегося
или восстанавливающегося на электродах
при прохождении через элемент 1 Кл
электричества. Видно, что химический
эквивалент связан с электрохимическим
эквивалентом соотношением:
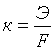 .
Показателем
эффективности электролиза является
выход по току η, %, определяемый как
отношение массы вещества, фактически
полученной в данных условиях электролиза
mпракт, к массе вещества, теоретически
вычисленной на основании закона Фарадея
mтеор:
.
Показателем
эффективности электролиза является
выход по току η, %, определяемый как
отношение массы вещества, фактически
полученной в данных условиях электролиза
mпракт, к массе вещества, теоретически
вычисленной на основании закона Фарадея
mтеор:
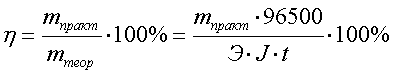 .
Области
применения электролиза:
получение
металлов;
очистка
металлов от примесей (рафинирование);
извлечение
ценных компонентов;
нанесение
на поверхность металлических изделий
слоев других металлов (гальваностегия);
получение
точных металлических копий с рельефных
предметов электроосаждением металла
(гальванопластика).
Пожарная
опасность процессов электролиза.
электролиз
из расплавов предполагает присутствие
высоких температур, что требует выполнения
правил пожарной безопасности;
процессы
очень энергоемкие, с использованием
электричества, что требует выполнения
правил электробезопасности;
возможность
образования при протекании процессов
водорода и кислорода, которые представляют
собой пожароопасные и поддерживающие
горение вещества;
возможность
образования кислот и щелочей, способных
вызвать активную коррозию металлических
конструкций электролизера;
возможность
образования хлора, который является
отравляющим веществом.
.
Области
применения электролиза:
получение
металлов;
очистка
металлов от примесей (рафинирование);
извлечение
ценных компонентов;
нанесение
на поверхность металлических изделий
слоев других металлов (гальваностегия);
получение
точных металлических копий с рельефных
предметов электроосаждением металла
(гальванопластика).
Пожарная
опасность процессов электролиза.
электролиз
из расплавов предполагает присутствие
высоких температур, что требует выполнения
правил пожарной безопасности;
процессы
очень энергоемкие, с использованием
электричества, что требует выполнения
правил электробезопасности;
возможность
образования при протекании процессов
водорода и кислорода, которые представляют
собой пожароопасные и поддерживающие
горение вещества;
возможность
образования кислот и щелочей, способных
вызвать активную коррозию металлических
конструкций электролизера;
возможность
образования хлора, который является
отравляющим веществом.
39.
Защита от коррозии Коррозии подвергается почти 1/3 вводимого в эксплуатацию металла. Часть его переплавляется и снгова возвращается в промышленность. Но всё-таки 10% от общей массы - теряется безвозвратно. Разрушение отдельных металлических деталей из металла может привлечь за собой разрушение целых маши и механизмов, создаваться аварийные ситуации. Радикальным методом защиты от коррозии является поиск коррозионно-стойких материалов для агрессивной среды. Полностью заменить металлы на неметаллические предметы - невозможно. Защита от коррозии: изоляция металлов от агрессивной среды. Защитить металл от разрушения можно путём создания на его поверхности защитной плёнки - покрытия.Пути создания защитных плёнок различны. Например, корродирующий металл покрывают слоем другого металла, который не разрушается при тех же условиях. В качестве покрыий используются неметаллические покрытия, органические материалы - плёнки высокополимерных веществ, лаки, олифа, а также композиции из высокополимерных и неорганических красящих веществ. Особое значение имеют плёнки из оксидов металлов, получаемые при действии кислорода или подходящих окислителей (азотная кислота HNO3, дихромат калия K2Cr2O7 и др.) на поверхность металлов. Часто такие оксидныеи плёнкки образуются на поверхности металлов даже просто при соприкосновении с воздухом, что делает химически-активные металлы (алюминий, циннк) коррозионностойкими. Подобную роль играют защитные нитридные покрытия, образующиеся при действии азота или аммиака на поверхность некоторых металлов. Искусственное оксидирование, азотирование, фосфатирование - хорошая защита металлов от коррозии. Электрохимическая защита от коррозии Электрохимическая защита металлов основана на изменении потенциала защищаемого металла и не связана с изоляцией металла от коррозионной среды. К ней относится катодная защита. Её называют также анодная защита. Катодная защита - заключается в том, что защищаемая конструкция "А", находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженный электрод) источника эжлектричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединяемый к аноду внешего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается. Протекторная защита - отличается от катодной защиты тем, что для её осуществления используется специальный анод - протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой конструкцией прододником электрического тока. В процессе коррозии протектор служит анодом (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу охраняемую конструкцию. Рассмотрим коррозионный процесс повреждения металлических защитных покрытий. 1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений). 2. Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальвангическая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк. Из этих случаев можно сделать вывод, что белее надёжное защитное покрытие то, что из металла более активного, чем защищаемый металл. Защита от коррозии. Ингибиторы коррозии Для замедления коррозии металлических изделий в агрессинвную среду добавляют вещества (чаще всего органические), называемые ингибиторами (замедлители окисления металла). Таким методом успешно пользуются, когда надо защитить металл от его разъедания кислотой. ингибиторы широко применяются при очистке паровых котлов от накипи, для снятия окалины с отработанных деталей, а также при хранении и перевозке соляной кислоты в стальной таре. В качестве органических ингибиторов применяют тиомочевину (химическое название - сульфид-диамид углерода C(NH2)2S ), диэтиламин, уротропин (CH2)6N4) и другие производные аминов. В качестве неорганических ингибиторов применяют силикаты (соединения металла с кремнием Si), нитриты (соединения с азотом N), дихроматы щелочных металлов и т.д. Иногда путём удаления из воды кислорода можно добится также снижение коррозионных свойств воды. А делают это путём фильтрования воды через слой железной стружки! |
|
|
Чистка стальных предметов Устранить ржавчину механическим способом практически невозможно. Поэтому часто применяют растворы, содержащие сильнодействующие химические реактивы - кислоты, основания и т.д. Вместе с устраненнием ржавчины достигается эффект предохранения поверхности от внешних возздействий. Несильно загрязнённые и поржавевшие предметы на несколько часов замичивают в бензине, а затем грязь и ржавчину удаляют салфеткой, смоченной бензином или металлической щёткой при глубокой ржавчине. Стальные предметы хорошо чистятся пастой, состав которой следующий: машинное масло - 650г, парафин - 150г, очень мелкая пемза - 200г иля тяжёлый бензин - 270г, абразивный порощок - 450г, алюминиевый порошок - 40г. Чистка цветных металлов В фарфоровом сосуде растапливают 100г парафина, 200г олеина, 200г овечьего жира. В полученную смесь добавляют 500г порошка мела и размешивают до полной гомогенизации. Чистка серебра В фарфоровой или эмалированной сосуде в 100мл тёплой воды последовательно растворяют 300г белого мыла, 150г щавелевой кислоты, 150г карбамида кальция. |
38. Коррозия металлов
Коррозия металлов - (от латинского corrodere - грызть) процессы, происходящие в результате химического воздействия окружающей среды, в результате которых происходит их разрушение. От этого процесса отличается другой процесс - эррозия металлов, представляющий собой разрушение их поверхности под механимеским воздействием среды. Коррозия металлов означает разъедание, - начинается также на их поверхности. Происходит химическое взаимодействие с окружающей средой. Это процесс является самопроизвольным, а также является следствием окислительно-восстановительных реакций с компонентами окружающей среды. В результате разрушения металла образуются продукты его окисления, а именно: оксиды, гидроксиды, иногда просто происходит егорастворение в среде до ионного состояния. Такое превращение сопровождается существенным изменением свойств. Известны различные виды коррозии металлов. Одним из основных её видов яляется химическая, которую иногда ещё называют газовой, так как иногда она происходит под воздействием газообразных компонентов из окружающей среды при высоких температурах. Химическая коррозия может происходить и под воздейстивем некоторых агрессивных жидкостей. Основным этого процесса является то, что она происходит без возникновения в ситеме электрического тока. Ей подвергаются детали и узлы машин, работающих в атмосфере кислорода при высоких тьемпературах, например турбинные двигатели, ракетные двигатели и некоторые другие, а также подвергаются детали узлы оборудования химического производства. Другим распространённым видом разрушения металлояв вляется электрохимическая коррозия - поверхностное разрушение в среде электролита с возникновением в системе электрического тока. Электрохимическая коррозия - разрушение в атмосфере, на почве, водоёмах, грунтах. Характер разрушения поверхности металла может быть различным и зависит от свойств этого металла и условиях протекакния процесса. Теперь остановимся подробнее на электрохимической коррозии
Электрохимическая коррозия
- наиболее распространённый видом разрушения металлов. Примером электрохимической коррозии является, например, разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере, под пленками влаги, в технических растворах, под действием смазочно-охлаждающих жидкостей и т.д. Как уже было отмечено, электрохимическая коррозия протекает на поверхности металлов под действием электрических токов, то есть происходят окислительно-восстановительные химические реакции, характеризующиеся отдачей электронов и их переносом, так как образуются катодные и анадные участки. Образованию катодов и анодов способствуют химическая неоднородность металлов (примеси и квлючения), наличие участков остаточной деформации, неоднородность покрывающих металл защитных плёнок и т.д. Наиболее часто в образовании данного вида разрушения металла учавствуют не один фактор, а несколько. Когда метал начинает корродировать, он превращается в многоэлектронный гальванический элемент. Например, рассмотрим что происходит, если медь Cu контактирует с железом Fe в среде электролита. Такая система представляет собой гальванический элемент, где железо - анод ("+"), а медь - катод. Железа отдают электроны меди и перехолят в раствор в виде ионов. Ионы водорода движутся к меди, где разряжаются. Катод постепенно становится более отрицательным, в конце концов становится равным потенциоалу анода и корроизия замедляется. Как раз на эту тему можно провести опыт в дамашних условиях. Нам потребуется три стакана с раствором поваренной соли (пищевая соль), 3 железных гвоздя, кусочек цинка и медная проволока (без изоляции). Итак, приступим. Первый гвоздь опустите в стакан с раствором соли. Ко второму гвоздю прикрутите медную проволоку, а к третьему - кусочек цинка. Затем опустите каждый гвоздь в свой стакан с раствором соли (их было 3) и оставьте их на 2-3 суток. Что происходит: все наши гвозди будут иметь следы ржавчины (коррозии). В самом худшем состоянии будет тот гвоздь, который находился в растворе вместе с медной проволокой, а меньше всего корродировал тот, который привязан к цинку! Объяснение: все металлы обладают разной способностью отдавать электроны. Сравнить их в этой способности можно, ознакомившись с рядом напряжений металлов: Li < K < Rb < Cs < Ba < Ca < Na < Mg < Al < Mn < Cr < Zn < Fe < Cd < Co < Ni < Sn < Pb < H2 < Cu < Ag < Hg < Pt < Au. Те металлы, которые в ряду напряжений находятся левее (например Zn - цинк находится левее Fe - железа), легче отдают свои электроны, чем металл справа (например Cu - медь правее Fe - железа). А значит, как только оба металла попадают в электролит (проводник тока- растовр соли), то сразу образуют гальваническую пару. Более активный металл (стоящий левее) заряжается положительно, а менее активный - отрицательно. Вернёмся к нашему опыту: тоже самое произошло и в наших стаканах с растворами. Железо (Fe) стоит левее, чем медь (Cu), поэтому оно заряжается положительно, при этом быстро окисляясь. В стакане с цинком - цинк (Zn) - более активный, чем железо. Поэтому, пока весь цинк не поржавеет, железо не разрушится (чем часто пользуются в технических целях).
Электрохимическая коррозия протекает интенсивнее, если в катод вкраплён металл, менее активный, чем корродирующий. Например, если корродирует сталь (а сталь - это сплав железа и углерода в котором частично образуется карбид железа) роль таких участков играет карбид железа (FeC).
Атмосферная коррозия - протекает во влажном воздухе при обычной температуре. Поверхность металла покрывается плёнкой влаги, содержащей растворённый кислород. Интенсивность разрушения металла возрастает с ростом влажности воздуха, а также содержанием в нём газообразных оксидов углерода, серы, при наличиив металле шероховатостей, трещин облегчающих конденсацию влаги.
Почвенная коррозия - её подвержены трубопроводы, кабели, подземные сооружения. В этом случае металлы соприкасаются с влагой почвы, содержащей растворённый кислород. Во влажной почве, с повышенной кислотностью трубопроводы разрушаются в течение полугода после их укладки (конечно, если не принять меры по их защите).
Электрическая коррозия - происходит под дейстивем блуждающих токов, возникающих от посторонних источников (линии электропередач,электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе). Блуждающие токи вызывают разрушение газопроводов, нефтепроводов,электрокабелей, различных сооружений. Под действием электрического тока на находящихся на земле металлических предметах появляются участки входа и выхода электронов - катоды и анады. На анодных участках наблюдается наиболее интенсивное разрушение.
37. Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Электродвижущая сила (ЭДС) — физическая величина, характеризующая работу сторонних (непотенциальных) сил в источниках постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль контура.
ЭДС можно выразить через напряжённость электрического поля сторонних сил (Eex). В замкнутом контуре (L) тогда ЭДС будет равна:
![]() ,
где dl —
элемент длины контура.
,
где dl —
элемент длины контура.
ЭДС так же, как и напряжение, измеряется в вольтах. Можно говорить об электродвижущей силе на любом участке цепи. Это удельная работа сторонних сил не во всем контуре, а только на данном участке. ЭДС гальванического элемента есть работа сторонних сил при перемещении единичного положительного заряда внутри элемента от одного полюса к другому. Работа сторонних сил не может быть выражена через разность потенциалов, так как сторонние силы непотенциальны и их работа зависит от формы траектории. Так, например, работа сторонних сил при перемещении заряда между клеммами тока вне самого источника равна нулю.
36.
