
59 Полимер образуется из мономеров в результате реакций полимеризации или поликонденсации. К полимерам относятся многочисленные природные соединения: белки, нуклеиновые кислоты, полисахариды, каучук и другие органические вещества.
По отношению к нагреву полимеры подразделяют на термопластичные и термореактивные. Термопластичные полимеры (полиэтилен, полипропилен, полистирол) при нагреве размягчаются, даже плавятся, а при охлаждении затвердевают. Этот процесс обратим. Термореактивные полимеры при нагреве подвергаются необратимому химическому разрушению без плавления. Молекулы термореактивных полимеров имеют нелинейную структуру, полученную путём сшивки (например, вулканизация) цепных полимерных молекул. Упругие свойства термореактивных полимеров выше, чем у термопластов, однако, термореактивные полимеры практически не обладают текучестью, вследствие чего имеют более низкое напряжение разрушения.
58. Пластмассы (пластические массы) или пластики — органические материалы, основой которых являются синтетические или природные высокомолекулярные соединения (полимеры). Исключительно широкое применение получили пластмассы на основе синтетических полимеров.
Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять после охлаждения или отвердения заданную форму. Процесс формования сопровождается переходом пластически деформируемого (вязкотекучего) состояния в стеклообразное состояние .Составные части пластмасс К составным частям пластмасс относятся: полимер (смола), наполнители, пластификаторы (эфиры), стабилизаторы, красители.
Свойства пластмасс можно модифицировать методами сополимеризации или стереоспецифической полимеризации, путём сочетания различных пластмасс друг с другом или с другими материалами, такими как стеклянное волокно, текстильная ткань, введением наполнителей и красителей, пластификаторов, тепло- исветостабилизаторов, облучения и др., а также варьированием сырья, например использование соответствующих полиолов и диизоцианатов при получении полиуретанов.
57. Деформация - это относительное смещение частиц тела, при котором не нарушается целостность самого тела. При течении материала деформация непрерывно и неограниченно увеличивается. Различают два вида течения - пластическое и вязкое. Пластическое течение возникает только тогда. когда прикладываемая сила превышает некоторый предел (предел текучести).Вязкое течение происходит под действием любых сил. в т.ч. и небольших. При сняти силы деформация может быть восстановлена (обратимоссть деформации). Реология изучает зависимости различных видов деформации от вызывающих ее напряжений.
Упругая деформация восстанавливается при снятии напряжения. Она обусловлена изменением межатомных расстояний в молекулярных цепях и деформацией валентных углов. Упругая деформация пропо(См. рис.рциональна величине действующих напряжений и обратно пропорциональна модулю упругости тела. (рис.1.3. стр.16 торнер 1972). Развитие больших упругих деформаций определяет характерную особенность механических свойств полимеров в любых физических состояниях.
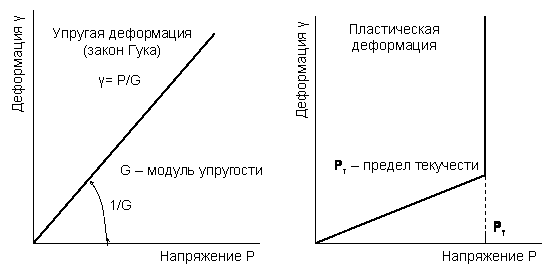
Высокоэластичные деформации связана с протекающими во времени процессом изменения конформации молекул. Деформация в высокополимерных материалах при температуре выше температуры стеклования является обратимой. Высокоэластичная деформация развивается во времени, при этом скорость деформации существенно зависит от температуры и сопровождается релаксацией. Скорость развития деформации под действием внешних сил непостоянна и изменяется от максимального значения в начальный момент до нулевого значения. При переходе материала из высокоэластичного состояния в стеклообразное проявляются релаксационные процессы.
Пластическая деформация представляет собой вязкое течение, связанное с необратимым перемещением молекул или их групп на расстояние больше размеров самих молекул. Скорость развития пластической деформации, также как и высокоэластической, зависит от температуры.
56. ВЯЗКОТЕКУЧЕЕ СОСТОЯНИЕ - одно из основных физ. состояний конденсиров. тел при к-ром они обладают текучестью, т.е. доминирующий вклад в их полную деформацию вносит необратимая составляющая В вязкотекучих средах, обладающих высокой вязкостью, флуктуационные упорядоченные образования могут длит. время сохраняться в сравнительно больших объемах. Это проявляется в структурной и физ.-хим. "памяти" материала к его термич. и мех. предыстории и отражается на кинетике и характере структурообразования при охлаждении, а также на реологич. св-вах расплава.
Стеклообразное - твердое агрегатное состояние с высокой плотностью упаковки макромолекул. При плотности упаковки приближается к твердому кристаллическому состоянию.
Для стеклообразного состояния характерен ближний порядок в расположении макромолекул и сильно ограниченная сегментальная подвижность.
Высокоэластическое состояние характеризуется высокой подвижностью всех составляющих макромолекул: атомов, групп, звеньев и сегментов. При приложении механической нагрузки макромолекулы легко меняют свою конформацию. Время структурной релаксации (время перехода из неравновесного состояния в равновесное) 10-5 - 10-6 с, тогда как для стеклообразного состояния 105 - 106 с, поэтому высокоэластическое состояние считается равновесным. Прочность полимеров в ВЭ состоянии приближается к прочности в СО состоянии.
55.
Фенолформальдегидные смолы -
продукты поликонденсации фенола с
формальдегидом. Реакция проводится в
присутствии кислых (соляная, серная,
щавелевая и другие кислоты) или щелочных
катализаторов (аммиак, гидроксид натрия,
гидроксид бария). При избытке фенола и
кислом катализаторе образуется линейный
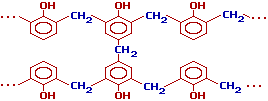
полимер –новолак,
цепь которого содержит приблизительно
10 фенольных остатков, соединенных между
собой метиленовыми мостиками:
![]() Новолаки
– термопластичные полимеры, которые
сами по себе не способны переходить в
неплавкое и нерастворимое состояние.
Но они могут превращаться в трехмерный
полимер при нагревании их с дополнительной
порцией формальдегида в щелочной
среде.
При
использовании щелочных катализаторов
и избытка альдегида в начальной стадии
поликонденсации получаются линейные
цепи резола,
которые при дополнительном нагревании
"сшиваются" между собой за счет
групп CH2OH,
находящихся в пара-положении
фенольного кольца, с образованием
трехмерного полимера – резита:
Новолаки
– термопластичные полимеры, которые
сами по себе не способны переходить в
неплавкое и нерастворимое состояние.
Но они могут превращаться в трехмерный
полимер при нагревании их с дополнительной
порцией формальдегида в щелочной
среде.
При
использовании щелочных катализаторов
и избытка альдегида в начальной стадии
поликонденсации получаются линейные
цепи резола,
которые при дополнительном нагревании
"сшиваются" между собой за счет
групп CH2OH,
находящихся в пара-положении
фенольного кольца, с образованием
трехмерного полимера – резита:
 Таким
образом, резолы являются термореактивными
полимерами.
Фенолоформальдегидные
полимеры применяются в виде прессовочных
композиций с различными наполнителями,
а также в производстве лаков и клея.
Таким
образом, резолы являются термореактивными
полимерами.
Фенолоформальдегидные
полимеры применяются в виде прессовочных
композиций с различными наполнителями,
а также в производстве лаков и клея.
54. Полимеризация — это процесс соединения друг с другом большого числа молекул мономера за счет кратных связей (С = С, С = О и др.) или раскрытия циклов, содержащих гетероатомы (О, N, S). При полимеризации обычно не происходит образования низкомолекулярных побочных продуктов, вследствие чего полимер и мономер имеют один и тот же элементный состав, Поликонденсация — зто процесс соединения друг с другом молекул одного или нескольких мономеров, содержащих две и да более функциональные группы (ОН, СО, СОС, NHS и др.) способные к химическому взаимодействию, при котором происходит отщепление низкомолекулярных продуктов. Полимеры, получаемые поликонденсационным способом, по элементному составу не соответствуют исходным мономерам.
Полимеризация мономеров с кратными связями протекает по законам цепных реакций в результате разрыва непредельных связей. Макромолекула при цепной полимеризации образуется очень быстро и сразу же приобретает конечные размеры, т. е не возрастает при увеличении длительности процесса. Полимеризация мономеров циклического строения происходит за счет раскрытия цикла и в ряде случаев пропекает не по цепному, а по ступенчатому механизму. Макромолекула при ступенчатой полимеризации образуется постепенно, т. е. сначала образуется димер затем тример и т.д., поэтому молекулярная масса полимера растет со временем. Принципиальное отличие ценной полимеризации от ступенчатой и от поликонденсации состоит в том, что на разных стадиях процесса реакционная смесь всегда состоит из мономера и полимера и не содержит ди-, три-, тетрамеров. С увеличением продолжительности реакции растет лишь число макромолекул полимера, а мономер расходуется постепенно. Молекулярная масса полимера не зависит от степени завершенности реакции или, что то же, от конверсии мономера, которая определяет только выход полимера.
53. . Полимеры — неорганические и органические, аморфные и кристаллические вещества, получаемые путём многократного повторения различных групп атомов, называемых «мономерными звеньями», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико. По химическому составу все полимеры подразделяются на органические, элементоорганические, неорганические.
Органические полимеры.
Элементоорганические полимеры. Они содержат в основной цепи органических радикалов неорганические атомы (Si, Ti, Al), сочетающиеся с органическими радикалами. В природе их нет. Искусственно полученный представитель — кремнийорганические соединения.
Следует отметить, что в технических материалах часто используют сочетания разных групп полимеров. Это композиционные материалы (например, стеклопластики).
По форме макромолекул полимеры делят на линейные, разветвленные (частный случай — звездообразные), ленточные, плоские, гребнеобразные, полимерные сетки и так далее.
Полимеры подразделяют по полярности (влияющей на растворимость в различных жидкостях). Полярность звеньев полимера определяется наличием в их составе диполей — молекул с разобщенным распределением положительных и отрицательных зарядов. В неполярных звеньях дипольные моменты связей атомов взаимно компенсируются. Полимеры, звенья которых обладают значительной полярностью, называют гидрофильными или полярными. Полимеры с неполярными звеньями — неполярными, гидрофобными. Полимеры, содержащие как полярные, так и неполярные звенья, называются амфифильными. Гомополимеры, каждое звено которых содержит как полярные, так и неполярные крупные группы, предложено называть амфифильными гомополимерами.
По отношению к нагреву полимеры подразделяют на термопластичные и термореактивные. Термопластичные полимеры (полиэтилен, полипропилен, полистирол) при нагреве размягчаются, даже плавятся, а при охлаждении затвердевают. Этот процесс обратим. Термореактивные полимеры при нагреве подвергаются необратимому химическому разрушению без плавления. Молекулы термореактивных полимеров имеют нелинейную структуру, полученную путём сшивки (например, вулканизация) цепных полимерных молекул. Упругие свойства термореактивных полимеров выше, чем у термопластов, однако, термореактивные полимеры практически не обладают текучестью, вследствие чего имеют более низкое напряжение разрушения.
Природные органические полимеры образуются в растительных и животных организмах. Важнейшими из них являются полисахариды, белки и нуклеиновые кислоты, из которых в значительной степени состоят тела растений и животных и которые обеспечивают само функционирование жизни на Земле. Считается, что решающим этапом в возникновении жизни на Земле явилось образование из простых органических молекул более сложных — высокомолекулярных (см. Химическая эволюция).
Под структурой полимеров понимают взаимное расположение в пространстве макромолекул, образующих полимер. Структура полимера зависит от величины, формы, строения макромолекул и характера взаимодействия между ними и обусловливает важнейшие свойства полимера. В зависимости от строения макромолекул различают три типа полимеров: линейные, разветвленные и пространственные.
51. Соединения элементов подгруппы хрома. Наиболее устойчивы
соединения трех- и шестивалентного хрома и шести валентных молибдена
и вольфрама. Соединения хрома и его аналогов в низших степенях окис-
ления обладают основными свойствами и являются восстановителями, со-
единения элементов в высших степенях окисления характеризуются
кислотными свойствами и являются сильными окислителями. Оксиды 62
металлов CrО3, МоО3, WО3 являются кислотными оксидами (ангидридами
кислот Н2МеО4), которые под действием расплавленных щелочей или кар-
бонатов щелочных металлов превращаются в соли типа Na2MeO4
(хроматы,
молибдаты и вольфраматы). Под действием галогеноводородов образуют ок-
сигалогениды МеОГ4 или МеО2Г2. Основным потребителем хрома является металлургическая промыш-
ленность. Хром широко используется для покрытия различных металли-
ческих деталей, которые защищают их от коррозии. Хроматы стронция
свинца и кадмия применяют для изготовления красок. Хроматы и дихро-
маты в химической промышленности используют как окислители. Смесь
насыщенного раствора К2Cr2О7 и концентрированной серной кислоты
(хромовая смесь) используют в лаборатории для мытья посуды. Молибден и
вольфрам идут на изготовление высококачественных специальных леги-
рованных сталей. Вольфрам используют для изготовления нитей накала
электроламп, выпрямителей переменного тока и антикатодов рентгенов-
ских трубок. Некоторые соединения вольфрама используют в качестве ка-
тализатора при производстве высококачественных бензинов.
Кислородсодержащие соединения марганца. С кислородом марга-
нец образует ряд оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7 и
Mn3O4 – смешанный оксид MnO
.
Mn2O3. В зависимости от степени окисле-
ния марганца изменяются свойства и характер оксидов и соответствую-
щих им гидроксидов. С увеличением степени окисления марганца кислот-
ные свойства соединений усиливаются, а основные свойства – уменьша-
ются. Соединения марганца(II) и марганца(III) проявляют основные свой-
ства, марганца(IV) – амфотерные свойства, марганца(VI) и марганца(VII)
– кислотные свойства.
Главным потребителем марганца является металлургическая про-
мышленность, для производства различных сплавов. Окислительные
свойства водного раствора перманганата калия используют для обезвре-
живания токсичных органических веществ. В результате окисления обра-
зуются менее токсичные продукты. Высокую окислительную способность
КMnО4 используют в экологии для оценки загрязнения сточных вод для56
определения содержания различных восстановителей. В медицине ис-
пользуют водные растворы перманганата калия с массовой долей
от 0,01 до 5 %, которые обладают антисептическими свойствами. Раствор
КMnO4 с массовой долей 5 % применяют в качестве кровоостанавливаю-
щего средства. Для лечения малокровия используют сульфат и хлорид
марганца(II). Диоксид марганца находит широкое применение в качестве
компонента активной массы электродов гальванических элементов, как
окислитель, адсорбент и катализатор.
6.1. Лабораторная работа. Свойства
Валентные электроны этих элементов относятся к двум энергетиче-
ским уровням. В химических реакциях они легко отдают два электрона с
4s-подуровня, с образованием соединений в которых они проявляют ва-
лентность равную двум и степень окисления +2. При образовании соеди-
нений с более высокой валентностью и степенью окисления (+3), металлы
отдают электроны с 4s-подуровня и с неполностью заполненного
d-подуровня. У железа наиболее устойчивыми являются соединения со69
степенью окисления +3, у кобальта и никеля – +2. Элементы семейства
железа в своих соединениях проявляют только положительные степени
окисления. Таким образом, как и все d-элементы они образуют связи за
счет орбиталей внешнего и предвнешнего слоев. Для элементов семейства
железа существует большое число различных нестехиометрических со-
единений (Fe3P, Fe4N, CoP3, Ni6S5 и других).
В нормальном состоянии элементы семейства железа на внешнем слое
имеют два электрона, поэтому для этих элементов характерны металличе-
ские свойства. Железо, кобальт и никель в виде простых веществ пред-
ставляют собой ферромагнитные серебристо-серые, тяжелые, тугоплавкие
металлы. Эти металлы обладают большой механической прочностью, мо-
гут прокатываться, протягиваться и штамповаться. Металлы семейства
железа теряют пластичность при загрязнении углеродом, кремнием, фос-
фором, серой и бором. Свойства металлов зависят от степени чистоты и
степени измельчения металлов. Железо один из самых распространенных
элементов в природе. В природе металлы семейства железа встречаются в
виде различных соединений (оксидов, сульфидов, арсенатов, карбонатов и дру-
гих соединений). Металлические железо, кобальт и никель получают вос-
становлением оксидов с помощью различных восстановителей (водорода,
оксида углерода(II), углерода, алюминия и т. д.), а также электролизом их солей.
Железо и его сплавы – основа современной промышленности. Кобальт
имеет большое значение в производстве легированных сталей и является
составной частью многих катализаторов. Радиоактивный изотоп
кобальт-60 используют в медицине для борьбы с раковыми заболевания-
ми. Никель также играет важную роль в производстве специальных сталей
и широко используется при никелировании металлов. Никель и кобальт
придают сталям твердость, коррозионную стойкость, высокие магнитные
свойства, жаропрочность, вязкость и т. д. Мелкодисперсный никель явля-
ется катализатором многих химических процессов.
С кислородом непосредст-
венно взаимодействует только медь. Оксиды серебра и золота со степенью
окисления +1 получают косвенным путем:
2 AgNO3 + 2 NaOH = Ag2O + H2O + 2 NaNO3
2 AuCl + 2 KOH = Au2O + H2O + 2 KCl
Оксиды типа Ме2О не взаимодействуют с водой, легко растворяются в
избытке аммиака и могут взаимодействовать с кислотами:
Ag2O + 4 NН3 + H2O = 2[Ag(NH3)2](OH)
Ag2O + 2 HСl = 2 AgCl + H2O
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Оксид CuO получают разложением при нагревании гидроксида
меди(II) или гидроксокарбоната меди(II):
Cu(OH)2↓ →t
CuO + H2O
(CuOH)2CO3 →t
2 CuO + CO2 + H2O
Все оксиды металлов подгруппы меди нерастворимы в воде, поэтому
гидроксиды этих элементов получают косвенным путем:
CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4
Гидроксиды меди(I) и серебра(I) и золота(III) неустойчивы, мало рас-
творимы и легко разлагаются на оксид и воду:
2 МеОН = Ме2О + H2O
Гидроксид меди(II) нерастворим в воде, легко растворяется в
кислотах:
Cu(OH)2↓ + Н2SO4 = CuSO4 + 2 H2O
При нагревании растворяется в концентрированных растворах щело-
чей и легко растворяется в водном растворе аммиака:
Cu(OH)2↓ + 2 NaOH(конц.)
→t
Na2[Cu(OH)4]
Cu(OH)2↓ + 4 NН3 = [Cu(NH3)4](OH)2
Общим свойством металлов подгруппы меди является большая склон-
ность к комплексообразованию, что не характерно для металлов главной
подгруппы.
Медь широко используют для получения разнообразных медных
сплавов: бронза, латунь, мельхиор и т. д. Основное использование меди –
изготовление проводов, обладающих малым электрическим сопротивле-
нием. Из соединений меди широко используют CuSO4 как составную
часть многих препаратов для борьбы с вредителями и болезнями сельско-90
хозяйственных культур. Оксид меди Cu2O используется как полупровод-
ник для изготовления выпрямителей переменного тока. Галогениды се-
ребра идут на изготовление светочувствительных фотопластинок, фото-
бумаг и пленок. Золото в основном используют для покрытия различных
изделий. Антисептические свойства растворимых солей серебра известны
давно и широко используются в настоящее время. Вода в серебряных со-
судах не подвергается микробному загрязнению и долго не портится.
Препараты серебра используют как противовоспалительные,
50. Понятие переходный элемент обычно используется в упрощенном смысле для обозначения любого из d- или f-элементов. Эти элементы действительно занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. Согласно более строгому определению, переходными называются элементы с валентными d- или f-электронами.
d-элементы называют главными переходными элементами. Они характеризуются внутренней застройкой d-орбиталей, так как s-орбиталь их внешней оболочки заполнена уже до заполнения d-орбитали. Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек.
d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутреннейзастройкой 3d-орбиталей. Здесь следует отметить две аномалии: хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
Большинство d-элементов кристаллизуется не в одной, а в нескольких формах. Ковкие и сравнительно мягкие металлы, как, например, медь, кристаллизуются в решетки по типу ГКУ. Более твердые металлы, как, например, хром, кристаллизируются по типу ОЦКУ. Железо кристаллизуется в решетке как по типу ГКУ, так и ОЦКУ.
Электронные конфигурации элементов четвертого периода от скандия до цинка
Элемент |
Символ |
Атомныйномер |
Электронная конфигурация |
Скандий Титан Ванадий Хром Марганец Железо Кобальт Никель Медь Цинк |
Sc Ti V Cr Mn Fe Co Ni Cu Zn |
21 22 23 24 25 26 27 28 29 30 |
1s2 2s22p6 3s23p63d1 4s2 1s2 2s22p6 3s23p63d2 4s2 1s2 2s22p6 3s23p63d3 4s2 1s2 2s22p6 3s23p63d5 4s1 1s2 2s22p6 3s23p63d5 4s2 1s2 2s22p6 3s23p63d6 4s2 1s2 2s22p6 3s23p63d7 4s2 1s2 2s22p6 3s23p63d8 4s2 1s2 2s22p6 3s23p63d10 4s1 1s2 2s22p6 3s23p63d1 4s2 ↑ ↑ Внутренняя Внешняя застройка оболочка |
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений.
Цинк не входит в число переходных элементов. Его физические и химические свойства не позволяют относить его к переходным металлам. В частности, в своих соединениях он обнаруживает только одно состояние окисления и не проявляет каталитической активности.
Строение Субатомные частицы
Основная статья: Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно современным научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов; все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11×10−31 кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726×10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929×10−27 кг). При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5×10−15 м, хотя размеры этих частиц определены плохо.
По современным научным представлениям как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.
Электроны в атоме
Основная статья: Атомная орбиталь
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количествомнейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий). Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[11][12]
Физические и химические свойства d-элементов
Физические свойства переходных металлов зависят от электронного
строения, от числа неспаренных d-электронов, которые могут участвовать
в образовании связей. Металлы, у которых по 3–4 неспаренных
d-электрона (элементы V–VI групп), имеют максимальную температуру
плавления и кипения. Переходные металлы, имеющие на внешнем
s-подуровне один электрон, как правило, имеют более высокую электри-
ческую проводимость (Cr, Мo и особенно Cu, Ag, Au). Элементы III-Б группы,
имеющие всего один d-электрон, по своим свойствам близки к соседним
щелочноземельным металлом, а металлы II-Б группы с полностью запол-
ненным d-подуровнем близки по свойствам к соседним р-элементам.
Химические свойства. С увеличением порядкового номера в побоч-
ных подгруппах металлические свойства элементов уменьшаются. Все
d-элементы являются восстановителями. Восстановительная способность
в растворах в пределах периода уменьшается. Наиболее сильными восста-
новителями являются металлы III-Б группы. У большинства d-элементов
образуются защитные оксидные пленки, вызывающие их пассивацию и
предохраняющие их от коррозии. Наиболее склонны к пассивации метал-
лы IV–VI групп. Элементы III и II-Б групп (кроме ртути) легко взаимодей-
ствуют с разбавленными кислотами, а лантан взаимодействует и с водой.
Не взаимодействуют с разбавленными кислотами металлы I-Б группы,
ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt). 48
Общим свойством d-элементов является способность образовывать
соединения, в которых они проявляют различные степени окисления (кро-
ме d-элементов II группы: цинка и кадмия). Поэтому для большинства
d-элементов характерны окислительно-восстановительные реакции.
Строение и свойства соединений d-элементов зависят от степени окисле-
ния металла. Переходные металлы, проявляющие переменную валент-
ность, в низшей степени окисления с сильными окислителями образуют
соединения, как правило, ионного типа с основными или амфотерными
свойствами. Большинство соединений d-элементов с низшей степенью
окисления проявляют восстановительные свойства. Соединения
d-элементов со слабыми окислителями (N, B, C, H, S, Si) являются металло-
подобными веществами, обладающими электрической проводимостью,
некоторые из них обладают сверхпроводимостью при низких температу-
рах. Для соединений, d-элементов в которых металл находится в высшей
степени окисления, характерны кислотные и окислительные свойства, при
этом они образуют полярные ковалентные химические связи.
С увеличением степени окисления в соединениях d-элементов усили-
ваются кислотные и окислительные свойства:
Mn+2O – Mn+32O3 – Mn+4O2 – Mn+6O3 – Mn+7 2O7
Mn(OH)2 – Mn(OH)3 – Mn(OH)4 – H2MnO4 – HMnO4
Кислотные свойства усиливаются, основные свойства уменьшаются
Окислительные свойства усиливаются, восстановительные уменьшаются
Так как атомы d-элементов и их ионы имеют большое число вакант-
ных орбиталей на внешнем (s- и р-орбитали) и предвнешнем (d- и у многих
f-орбитали) энергетическом уровне и относительно большой радиус, то для
них характерны реакции комплексообразования.
При этом d-элементы могут образовывать комплексные соединения
различных типов:
а) нейтральные комплексы [Mn(CO)5] или [Pt(NH3)2Cl2];
б) катионные комплексы [Cu(NH3)4]2+
; [Cr(H2O)6]3+
;
в) анионные комплексы [Fe(CN)6]3-или [PtCl4]2-
.
Прочность комплексов с одинаковыми лигандами возрастает с увели-
чением заряда иона металла и уменьшением его радиуса.
Так как переходные металлы и их ионы имеют неспаренные электро-
ны, способные при поглощении световой энергии переходить с основных
энергетических уровней и подуровней на более высокие уровни (в возбуж-49
денное состояние), то большинство ионов металлов и их соединений окра-
шены. Окраска зависит от разности энергии основного и возбужденного
состояний и длин поглощаемого света. Многие d-элементы, особенно
металлы VIII и I групп используются в качестве катализаторов для
различных реакций.
49. В подгруппу входят углерод, кремний, германий, олово, свинец. На
внешнем энергетическом уровне имеется 4 электрона - s2p2
, из которых два
p-электрона неспарены. В невозбужденном состоянии образуются две
связи за счет двух неспаренных электронов и одну донорно-акцепторную
связь за счет вакантной p-орбитали. При возбуждении возникает 4
неспаренных электрона (один из s-электронов переходит на p-подуровень)
и становится возможным образование 4-х связей. Вследствие sp3-
гибридизации эти 4 связи становятся равноценными.
Характерными степенями окисления элементов 4А группы являются +2,
+4, -4. Углерод и кремний наиболее устойчивы в степени окисления +4, а
германий, олово и свинец - в степени окисления +2.
1. По мере роста радиуса атомов уменьшается електроотрицательность
этих элементов и облегчается ионизация их атомов.
Электроотрицательность углерода 2,50, кремния 1,74, германия 1,7, олова
1,7, свинца 1,55. Углерод и кремний типичные неметаллы германий, олово
и свинец - амфотерные элементы.
2. С водородом элементы 4-ой группы образуют гидриды: CH4, SiH4,
GeH4, SnH4, PbH4. Эти гидриды не имеют кислотно-основных свойств, как
например, гидриды галогенов, халькогенов или элементов 5А группы.
3. С кислородом элементы образуют два типа оксидов: СO и CO2, SiO и
SiO2, GeO и GeO2, SnO и SnO2, PbO и PbO2. При этом СO2 и SiO2 - кислотные
оксиды (им соответствуют кислоты H2CO3 H2SiO3), GeO2, SnO2, PbO2 -амфотерные оксиды (им соответствуют амфотерные гидроксиды - Ge(OH)4,
Sn(OH)4, Pb(OH)4.
Кремний - общие свойства
Второй по распространенности элемент земной коры - 27,6%. Природный
кремний состоит из 3-х стабильных изотопов c массовыми числами 28 (92,8%), 29
(4,7%) и 30 (3,1%). В условиях sp3
-гибридизации образует 4 равноценных
ковалентных связей. Типичная степень окисления +4, реже +2 и -4. Соединения
Si+2
- неустойчивы. В атоме кремния (в отличие от атома углерода) имеется
вакантная d-орбиталь и может происходить образование дополнительных
донорно-акцепторных связей, как например, в соединениях с кислородом,
которые отличаются более высокой прочностью химических связей, чем
соединения углерода.
Кристаллический кремний - темно-серое вещество с металлическим блеском,
плавится при 1415оС.
12.2. Химические свойства кремния
Кремний довольно инертное вещество и его химическая активность
проявляется преимущественно при высоких температурах.
4.7. Кремний взаимодействует с кислородом при 400-500оС, а с
водородом - при 3000oCto to
Si + O2 = SiO2 Si + 2H2 = SiH4 (cилан)
2. Кремний взаимодействует с фтором при обычной температуре, а с остальными
галогенами при нагревании.
to
Si + 2F2 = SiF4 Si + 2Cl2 = SiCl4 Si + 2Br2 = SiBr4
Галогениды кремния гидролизуются водой с образованием кремневой кислоты
или диоксида кремния (если гидролиз идет при нагревании).
to
SiСl4 + 3H2O = H2SiO3 + 4HCl SiCl4 + 2H2O = 4HCl + SiO2
3. Взаимодействие с другими неметаллами также идет при нагревании:
to to to
Si + 2S = SiS2 3Si + 2N2 = Si3N4 Si + C = SiC
4. При нагревании кремния с металлами образуются силициды. Силициды
разлагаются водой и кислотами с образованием силана (основной способ
получения силана). Силан горит и разлагается щелочью.
to to
2Ca + Si = Ca2Si 2Mg + Si = Mg2Si
Сa2Si + 4HCl = 2CaCl2 + SiH4 Сa2Si + 4H2O = 2Ca(OH)2 + SiH4
SiH4 + 2О2 = SiO2 + 2H2O SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2
5. Кислоты, кроме плавиковой, на кремний не действуют, в щелочах кремний
растворяется с выделением водорода.
Si + 4HF = SiF4 + 2H2 Si + 2NaOH + H2O = Na2SiO3 + 2H2
6. При нагревании кремний разлагает воду.
Si + 2H2O = SiO2 + 2H2
12.3. Получение и применение кремния
Основным способом получения кремния является восстановление из диоксида
кремния, а наиболее чистый кремний - восстановлением SiCl4.
SiO2 + 2C = Si + 2CO 3SiO2 + 4Al = 3Si + 2Al2O3
SiO2 + 2Mg = Si + 2MgO SiCl4 + 2Zn = Si + 2ZnCl2Из областей применения кремния можно указать на изготовление
полупроводниковых приборов (электроника), фотоэлементов (в т.ч.
энергетических), жаропрочных сплавов (ферросилиций)
12.4. Соединения кремния
А. Монооксид кремния - SiO
В твердом состоянии это полимер. В виде индивидуальных молекул - SiO
находится только в парообразном состоянии. Нестойкое соединение и легко
окисляется в диоксид кремния.
2SiO + O2 = 2SiO2 Получают по реакции: SiO2 + Si = 2SiO
УГЛЕРОД
ХИМИЧЕСКОЕ При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
ФИЗИЧЕСКОЕ Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовыватьхимические связи разного типа.
Часть земной оболочки, занятой растительными и животными организмами и переработанная ими и космическими излучениями и приспособленная к жизни, называют биосферой (по Вернадскому).
Л. П. Виноградов считал, что концентрация элементов в живом веществе прямо пропорциональна его содержанию в среде обитания с учетом растворимости их соединений. По мнению А. П. Виноградова химический состав организма определяется составом окружающей среды. Биосфера содержит 100 млрд тонн живого вещества. Около 50% массы земной коры приходится на кислород, более 25% на кремний. Восемнадцать элементов (О, Si, Al, Fe, Ca. Na, К, Mg, H, Ti, С, Р, N, S, Cl, F, Мn, Ва) составляют 99,8% массы земной коры. Живые организмы принимают активное участие в перераспределении химических элементов в земной коре. Минералы, природные химические вещества, образуются в биосфере в различных количествах, благодаря деятельности живых веществ (образование железных руд, горных пород, в основе которых соединения кальция). Кроме этого, оказывают влияние техногенные загрязнения окружающей среды. Изменения, происходящие в верхних слоях земной коры, влияют на химический состав живых организмов. В организме можно обнаружить почти все элементы, которые есть в земной коре и морской воде. Пути поступления элементов в организм разнообразны. Согласно биогеохимической теории Вернадского существует «биогенная миграция атомов» по цепочке воздух> почва®вода®пища®человек, в результате которой практически все элементы, окружающие человека во внешней среде, в большей или меньшей степени проникают внутрь организма.
Содержание некоторых элементов в организме по сравнению с окружающей средой повышенное – это называют биологическим концентрированием элемента. Например, углерода в земной коре 0,35%, а по содержанию в живых организмах занимает второе место (21%). Однако эта закономерность наблюдается не всегда. Так, кремния в земной коре 27,6%, а в живых организмах его мало, алюминия – 7,45%, а в живых организмах -1·10-5%.
48. Жесткость воды - определенное свойство воды, которое связывают с растворенными в ней соединениями магния и кальция, то есть наличием в воде катионов этих элементов (при повышении температуры соли этих металлов выпадают в осадок и образуют весьма прочные отложения). Жесткость воды во многом определяет пригодность воды для использования как промышленных, так и в бытовых целях. Возникновением накипи мы «благодарны» именно жесткой воде.
Жесткость воды принято исчислять суммой миллимолей ионов кальция и магния на 1 литр воды (ммоль/л). 1 ммоль/л соответствует количеству любого вещества в мг/л, равному его молекулярной массе, разделенной на валентность. Величина 1 ммоль/л говорит о содержании в 1 литре воды 20,04 мг/л кальция либо 12,1 б мг/л магния. Для удобства пользуются величиной мг-экв/л, которая соответствует моль/м3. Кроме того, в зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус, ppm карбоната кальция.
Выделяют 2 типа жесткости воды: - временная – карбонатная жесткость, обусловлена присутствием на ряду с кальцием, магнием и железом гидрокарбонатных анионов; - постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов, соли кальция и магния которых прекрасно растворяются в воде; - общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости.
Принято классифицировать жесткость воды следующим образом: - мягкая вода – жесткость 3,0 мг-экв/л и более - средняя жесткость – от 3,0 до 6,0 мг-экв/л - жесткая вода – свыше 6,0 мг-экв/мл.
Причиной жесткости воды является подземные залежи известняков, гипса, доломитов, которые растворяются в подземных водах, а также отчасти, других процессов растворения и выветривания горных пород. Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость воды, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%). С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л. Содержание же ионов магния (Mg2+) в высокоминерализованных водах может достигать нескольких граммов, а в соленых озерах - десятков граммов на один литр воды.
В целом, жесткость поверхностных вод меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Приемлемость жесткости воды для питьевых нужд зависит от конкретных местных условий. Порог вкуса для иона кальция находится в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния - значительно ниже (в отдельных случаях приемлема вода жесткостью в 10 мг-экв/л). Жесткая вода имеет горьковатый вкус и негативно воздействует на органы пищеварения, органолептические свойства воды отвечают низкому уровню.
Однако мягкая вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость и может, в зависимости от значения рН и других параметров влиять на коррозионную активность водоводов (в данном случае повышать их устойчивость и работоспособность). В теплотехнике в некоторых случаях проводят специальную химподготовку воды с целью достижения оптимального и эффективного соотношения между жесткостью воды и ее коррозионной активностью.
47. Огромная роль воды в жизни человека и природы послужила причиной
того, что она была одним из первых соединений, привлекших внимание учёных.
Тем не менее изучение воды ещё далеко не закончено.
Общие свойства воды.
Вода в силу популярности её молекул способствует разложению
контактирующих с ней молекул солей на ионы, но сама вода проявляет большую
устойчивость и в химически чистой воде содержится очень мало ионов
по H+ и OH-.
Вода - инертный растворитель; химически не изменяется под действием
большинства технических соединений, которые она растворяет. Это очень важно
для всех живых организмов на нашей планете, поскольку необходимые их тканям
питательные вещества поступают в водных растворах в сравнительно мало
измененном виде. В природных условиях вода всегда содержит то или иное
количество примесей, взаимодействия не только с твердыми и жидкими
веществами, но растворяя также и газы.
Даже из свежевыпавшей дождевой воды можно выделить несколько десятков
миллиграммов различных растворенных в ней веществ на каждый литр объема.
Абсолютно чистую воду никогда и никому ещё не удавалось получить ни в одном
из её агрегатных состояний; химически чистую воду, в значительной мере
лишенную растворенных веществ, производят путем длительной и кропотливой
очистки в лабораториях или на специальных промышленных установках.
В природных условиях вода не может сохранить “химическую чистоту”.
постоянно соприкасаясь со всевозможными веществами, она фактически всегда
представляет собой раствор различного, зачастую очень сложного свойства. В
пресной воде содержание растворенных веществ обычно превышает 1 г./л. От
нескольких единиц до десятков граммов на литр колеблются содержание солей в
морской воде: например, в Балтийском море их всего 5 г./л., в Чёрном - 18,
а в Красном море - даже 41 г./л.
Солевой состав морской воды в основном на 89% слагается из хлоридов
(преимущественно хлорида натрия, калия и кальция), 10% приходится на
сульфаты (натрия, калия, магния) и 1% - на карбонаты (натрия, кальция) и
другие соли. Пресные воды содержат обычно больше всего - до 80% карбонатов
(натрия и кальция), около 13% сульфатов (натрия, калия, магния) и 7%
хлоридов (натрия и кальция).
Вода хорошо растворяет газы (особенно при низких температурах),
главным образом кислород, азот, диоксид углерода, сероводород. Количество
кислорода иногда достигает 6 мг./л. В минеральных водах типа нарзан общее
содержание газов может составлять до 0,1%. В природной воде присутствуют
гумусовые вещества - сложные органические соединения, образующиеся в
результате неполного распада остатков растительных и животных тканей, а
также соединения типа белков, сахаров, спиртов.
Вода обладает исключительно высокой теплоемкостью. Теплоемкость воды
принята за единицу. Теплоемкость песка, например, составляет 0,2, а железа
- лишь 0,107 теплоемкости воды. Способность воды накапливать большие запасы
тепловой энергии позволяет сглаживать резкие температурные колебания на
прибрежных участках Земли в различные времена года и в различную пору
суток: вода выступает как бы регулятором температуры на всей нашей планете.
Следует отметить особое свойство воды - её высокое поверхностное
натяжение - 72,7 эрг/см2 (при 20о С). В этом отношении из всех видов
дидкостей вода уступает только ртути. Подобное свойство воды во многом
обусловлено водородными связями между отдельными молекулами H2O. Особенно
наглядно проявляется поверхостное натяжение в прилипании воды ко многим
поверхностям - смачивании. Установлено, что вещества - глина, песок,
стекло, ткани, бумага и многие другие, легко смачиваемые водой, непременно
имеют в своем составе атомы кислорода.такой факт оказался ключевым при
обьяснении природы смачивания: энергитически не уравновешенные молекулы
поверхностного слоя воды получают возможность образовать дополнительные
связи с “чужими” атомами кислорода.
Смачивание и поверхностное натяжение лежат в составе явления,
названного капилярностью: в узких каналах вода способна подниматься на
высоту гораздо большую, чем та, которую “ позволяет” сила тяжести для
столбика данного сечения.
В капилярах вода обладает поразительными свойствами. Б.В.Дерягин
установил, что в капилярах вода, сконденсировавшаяся из водяного пара, не
замерзает при 00 и даже при снижении темрературы на десятки градусов.
Молекулы воды отличаются большой термической устойчивостью, при
деструкции по схеме: 2H2O ( 2H2 + O2 + 2 ( 245,6 Кдж.
начинается при температуре выше 10000С, и при 20000С составляет лишь 1,8%.
При 50000С водяной пар со взрывом нацело разлагается на водород и кислород.
Вода относится к слабым электролитам.
H2O ( H+ + OH-
Kдисс=
= 1,8(10-16
[H+][OH-]
[H2O]
Вода весьма реакционноспособное вещество: может проявлять как
окислительнын, так и восстановительные свойства. Так, под действием сильных
восстановителей вода проявляет окислительные свойства: на холоде окисляет
щелосные и щелочноземельные металлы, а при температуре накаливания -
железо, углерод и др.
2Na + 2H2O ( 2NaOH + H2(
3Fe + 4H2O ( Fe3O4 + 4H2(
Под действием сильных окислителей (фтор, хлор, электрический ток)
вода проявляет восстановительные свойства. Так, реакцию взаимодействия со
фтором можно представить следующим образом:
2F2+2H2O ( 2H2F2+O2(
Cуществует три типа присоединения воды к молекулам других веществ: по
ионному, координатному и адсобционному типу.
Присоединение по ионному типу происходит к оксидам щелочных,
щелочноземельных и редкоземельных металлов, а также к кислотным оксидам:
CaO + H2O ( Ca (OH)2
P2O5 + 3H2O ( 2H3PO4
Вода, присоединяемая по ионному типу, называется конституционной. Она
удаляется при нагревании с большим трудом. Так отщепление от едкого натра
начинается при 1388oС :
2NaOH ( Na2O + H2O
К ионам металлов - комплексообразователей присоединение идёт по
координатному типу :
[
]
CaCl2 + CH2O ( Ca(H2O)6 ( Cl2
Полученные соединения называются аквакомплексами, а вода, вошедшая в
их состав, - кристаллизационной. Кристаллизационная вода удаляется
легче,чем конституционная, например, при выветривании.
Различные вещества адсорбируют на своей поверхности некоторое
количество воды за счет межмолекулярных сил притяжения. Вода,
присоединенная по адсорбционному типу, называется гигроскопической; она
удаляется легче, чем кристалллизационная.
Ионный состав природных вод.
Происходящее в почвах процессы окисления органических веществ
вызывают расход кислорода и выделение углекислоты, поэтому в воде при
фильтрации её через почву возрастает содержание углекислоты, что приводит к
обогащению природных вод карбонатами кальция, магния и железа, с
ообразованием растворимых в воде кислых солей типа:
CaCO3 + H2O + CO2 ( Ca(HCO3)2
Бикарбонаты присутствуют почти во всех водах в тех или иных
количествах. Большую роль в формировании химического состава воды играют
подстилающие почву грунты, с которыми вода вступает в соприкосновение,
фильтруясь и растворяя некоторые минералы. Особенно интенсивно обогащают
воды осадочные породы,такие, как известняки, доломиты,мергели, гипс,
каменная соль и др. В свою очередь почва и породы обладают способностью
адсорбировать из природной воды некоторые ионы ( например, Ca2+ , Mg2+ ),
замещая их эквивалентным количество других ионов ( Na+ , K+ ).
Подпочвенными водами легче всего расстворяются хлориды и сульфаты
натрия и магния, хлорид кальция. Силикатные и алюмосиликатные породы
( граниты, кварцевые породы и т.д. ) почти нерасстворимы в воде и
содержащей углекислоту и органические кислоты.
Наиболее распространенними в природных водах являются следующие
ионы : Cl- ,SO[pic] ,HCO[pic] ,CO[pic] ,Na+ ,Mg2+ ,Ca2+ ,H+.
Ион хлора присутствует почти во всех природных водоемах, причем его
содержание меняется в очень широких пределах. Сульфат - ион также
распространен повсеместно. Основным источником растворенных в воде
сульфатов является гипс. В подземных водах с содержанием сульфат - иона
обычно выше, чем в воде рек и озер. Из ионов щелочных металлов в природных
водоемах в наибольших количествах находится ион натрия, который является
характерным ионом сильноминерализованных вод морей и океанов.
Ионы кальция и магния в маломинерализованных водах занимают первое
место. Основным источником ионов кальция является известняки, а
магния - доломиты (MgCO3 ,CaCO3). Лучшая расстворимость сульфатов и
карбонатов магния позволяет присутствовать ионам магния в природных водах в
больших концентрациях, чем ионов кальция.
Ионы водорода в природной воде обусловлены диссоциацией угольной
кислоты. Большинство природных вод имеют pH в пределах 6,5 - 8,5. Для
поверхностных вод в связи с меньшим содержанием в них углекислоты pH обычно
выше, чем для подземных.
Соединения азота в природной воде представлены ионами аммония,
нитритными, нитратными ионами за счет разложения органических веществ
животного и растительного происхождения. Ионы аммония, кроме того, попадают
в водоемы со сточными промышленными водами.
Соединения железа очень часто встречаются в природных водах, причем
переход железа в раствор может происходить под действием кислорода или
кислот ( угольной, органических(. Так например, при окислении весьма
распространенного в породах пирита получается сернокислое железо:
FeS2 + 4O2 ( Fe2+ + 2SO[pic]
а при действии угольной кислоты - карбонат железа:
FeS2 + 2H2CO3 ( Fe2+ + 2HCO3 + H2S + S.
Соединения кремния в природных водах могут быть в виде кремнеивой
кислоты. При pH < 8 кремниевая кислота находится практически в
недиссоциированном виде; при pH >8 кремниевая кислота присутствует
совместно с HSiO[pic], а при pH >II - только HSiO[pic]. Часть кремния
находится в коллоидном состоянии, с частицами состава HSiO2(H2O , а также в
виде поликремнеивой кислоты: X(SiO2(y(H2O. В природных водах присутствуют
также Al3+ ,Mn2+ и другие катионы.
Помимо веществ ионного тапа природные воды содержат также газы и
органические и грубоцисперсные взвеси. Наиболее распространенными в
природных водах газами являются кислород и углекислый газ. Источником
кислорода является атмосфера, углекислоты - биохимические процессы,
происходящие в глубинных слоях земной коры, углекислота из атмосферы.
Из органических веществ, попадающих извне, следует отметить гуминовые
вещества, вымываемые водой из гумусовых почв (торфянников, сапропелитов и
др.). Большая часть из них находится в коллоидном состоянии. В самих
водоемах органические вещества непрерывно поступают в воду в результате
отмирания различных водных организмов. При этом часть из них остается
взвешенной в воде, а другая опускается на дно, где происходит их распад.
Грубодисперсные примеси, обуславливающие мутность природных вод,
представляют собой вещества минерального и органического происхождения,
смываемые с верхнего покрова земли дождями или талыми водами во время
весенних паводков.
Подземные воды.
Советский ученый лебедев на основе многочисленных экспериментов
разработал классификацию видов воды в почвах и грунтах. Представления
А.Ф.Лебедева, получившие дальнейшее развитие в более поздних исследованиях,
позволили выделить следующие виды воды в горных породах: в форме пара,
связанную, свободную, в твердом состоянии.
Парообразованная вода занимает в породе поры, не заполненные жидкой
водой, и перемещается за счет различной величины упругости пара или потоком
воздуха. Конденсируясь на частицах породы, водяные пары переходят в другие
виды влаги.
Различают несколько видов связанной воды. Сорбированная вода
удерживается частицами породы под влиянием сил, возникающих при
взаимодействии молекул воды с поверхностью этих частиц и с обменными
катионами. Сорбированную воду разделяют на прочносвязанную и
рыхлосвязанную. Если влажную глину подвергать давлению, то даже под
давлением в несколько тысяч атмосфер часть воды невозможно удалить из
глины. Это прочносвязанная вода. Полное удаление такой воды достигается
лишь при температуре 150 - 300оС. Чем меньше минеральные частицы, слагающие
породу, и, следовательно, выше их поверхностная энергия, тем большее
количество прочносвязанной воды в этой породе. Рыхлосвязанная, или
пленочная, вода образует плёнку вокруг миниральных частиц. Она удерживается
слабее и довольно легко удаляется из породы под давлением. Особенно важную
роль играет сорбированная вода в глинистых породах. Она влияет на
просностные свойства глин и фильтрационную способность.
Как уже указывалось, связанная вода участвует в строении
кристаллических решёток некоторых минералов. Кристаллизационная вода входит
в состав кристаллической решётки. Гипс, например содержит две молекулы воды
CaSO4(2H2O. При нагревании гипс теряет воду и превращается в ангидрит
(CaSO4).
Известно, что при температуре около 4оС вода имеет максимальную
плотность 1,000 г/см3. При 100оС её плотность - 0,958 г/см3, при 250оС -
0,799 г/см3. За счет пониженной плотности происходит конвективное,
восходящее движение нагретых подземных вод.
Принято считать, что вода практически несжимаема. Действительно,
коэффициент сжимаемости воды, показывающий, на какую долю первоначального
объема уменьшится объём воды при увеличении давления на I aт, очень мал.
Для чистой воды он равен 5(10-5 I/ат. Однако упругие свойства воды, а также
водовмещающих пород играют важнейшую роль в подземной гидродинамике. За
счет сил упругости создается напор подземных вод. Температура и давление
действуют на плотность воды в противоположном направлении.
Плотность подземных вод зависит также от их химического состава и
концентрации солей. Если пресные подземные воды имеют плотность, близкую к
1 г/см3, то плотность концентрированных рассолов достигает 1,3 - 1,4 г/см3.
Повышение температуры приводит к значительному уменьшению вязкости
подземных вод и, таким образом, облегчает их движение через мельчайшие
поры.
Подземные воды исключительно разнообразны по свому химическому
составу. Высокогорные источники обычно дают очень пресную воду с низким
содержанием растворенных солей, иногда менее 0,1 г. в 1 л., а в одной из
скважин в Туркменистане был рассол с минерализацией 547 г/л.
ЛИТЕРАТУРА:
46.
Наиболее крупными потребителями данной продукции являются черная металлургия, строительная индустрия, целлюлозно-бумажная промышленность, химическая промышленность, сахарная промышленность и сельское хозяйство. Также в значительных объемах известь используется для охраны окружающей среды (нейтрализация сточных вод и дымовых газов). В промышленно-развитых странах потребление извести в настоящее время составляет около 80 кг на душу населения в год. Общемировое производство извести, включая небольших производителей в развивающихся странах, а также производителей извести для собственных нужд (металлургические заводы, целлюлозно-бумажные и сахарные комбинаты), оценивается в 300 млн. тонн в год. Из них на рынок поступает около 120 млн. тонн в год. По объему производства извести Россия занимает одно из лидирующих мест, ежегодно выпуская более 10 млн. тонн, а строительной извести около 4 млн. тонн. Строительной известью называют продукт, получаемый путем обжига до возможно полного выделения углекислоты кальциево-магниевых горных пород, содержащих не более 8% глинистых и песчаных примесей. В качестве сырья используют карбонатные породы - известняк, мел, ракушечник, доломитизированный известняк.
Виды извести
По количеству содержащихся в извести силикатов и алюмоферритов кальция, придающих ей гидравлические свойства, различают:
- воздушную, обеспечивает затвердевание строительных растворов и сохранение ими прочности в условиях нормальной влажности; - гидравлическую, обеспечивает затвердевание и сохранение прочности растворов, применяемых как на воздухе, так и в воде.
В воздушной извести силикаты и алюмоферриты кальция составляют обычно 4-12%, в отдельных случаях до 20%. При содержании в извести 25-40% клинкерных минералов она проявляет слабые гидравлические свойства, такая известь называется слабогидравлической. Сильногидравлическая известь содержит силикаты и алюмоферриты кальция в количестве 40-90%.
По виду содержащегося в воздушной извести основного окисла она может быть: - кальциевой; - магнезиальной; - доломитовой. Кальциевая известь содержит 70-96% СаО и до 2% MgO. Маломагнезиальная известь состоит из 70-90% СаО и в пределах 2-5% MgO. В магнезиальной извести MgO содержится в пределах - 5-20%, в доломитовой - 20-40%.
В зависимости от вариантов дальнейшей обработки обожженного продукта различают несколько видов воздушной извести: - негашеную комовую известь — кипелку, состоящую главным образом из Са(ОН) ; - негашеную молотую известь — порошкообразный продукт помола комовой извести; - гидратную известь (гашеная) — пушонку — тонкий порошок, получаемый в результате гашения комовой извести определенным количеством воды и состоящий в основном из Са(ОН) ; - известковое тесто — тестообразный продукт гашения комовой извести, состоящей в основном из Са(ОН) и механически примешанной воды; - известковое молоко — белая суспензия, в которой гидроксид кальция находится частично в растворенном, а частично во взвешенном состоянии.
По времени гашения все сорта воздушной негашеной извести подразделяют на три группы: - быстрогасящаяся - время гашения не более 8 мин; - среднегасящаяся - время гашения не более 25 мин; - медленногасящаяся - время гашения не менее 25 мин. Порошкообразную известь, получаемую путем размола или гашения (гидратации) комовой извести, подразделяют на: известь без добавок и с добавками.
Свойства и технические характеристики
Строительную известь изготавливают в соответствии с требованиями государственного стандарта по технологическому регламенту, утвержденному в установленном порядке. В производстве строительной извести используются следующие материалы: карбонатные породы, минеральные добавки (гранулированные доменные или электротермофосфорные шлаки, активные минеральные добавки, кварцевые пески). Они должны удовлетворять требованиям соответствующих действующих нормативных документов. Воздушная негашеная известь без добавок подразделяется на три сорта: 1, 2 и 3; негашеная порошкообразная с добавками — на два сорта: 1 и 2; гидратная (гашеная) без добавок и с добавками на два сорта: 1 и 2.
