
- •1) Внутренняя энергия – функция состояния системы. 1 закон термодинамики.
- •2. Связь с термодинамическими параметрами
- •3) Энтальпия
- •4) Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процесс).
- •5) Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процесс).
- •6) Теплоемкость и ее зависимость от температуры
- •7) Закон Гесса – основной закон термохимии.
- •8) Уравнение Кирхгоффа в дифференциальной форме.
- •9) Уравнение Кирхгоффа в интегральной форме.
- •11. Работа обратимого и необратимого процессов
- •12.Цикл Карно
- •13. Энтропия обратимых процессов.
- •14. Энтропия не обратимых процессов.
- •15. Статический смысл энтропии.
- •16. Вычисление изменения энтропии в различных термодинамических процессах
- •17. Свободная энергия Геймгольца
- •18.Свободная энергая Гиббса
- •19 Уравнение Гибса-Гельмгольца
- •20 Понятие о химическом потенциале
- •21. Химический потенциал идеального и реального газов. Летучесть
- •22 Закон действующих масс. Константа равновесия
- •23 Изотерма химической реакции Ван Гоффа.
- •24 Уравнение изобары Вант Гоффа
- •25 Уравнение изохоры Вант Гоффа
- •26 Теорема Нернста 3 закон термодинамики
- •27 Постулат Планка
17. Свободная энергия Геймгольца
Энтропия является критерием оценки в направлении протекании системы. На практике рассматриваются системы закрытые и открытые для таких систем вводятся новые функции состояния рассмотрим закрытые системы.
V,T изохорно изотермический
dU=əQ
- əW
əQ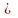 TdS
dU
TdS
- əW
əW
- dU+
TdS
TdS
dU
TdS
- əW
əW
- dU+
TdS
əW - d(U-TS) F=U-TS əW - dF
F – изохорноизотермический потенциал или свободная энергия Гейм-Гольца. Эта часть внутренней энергии которая может быть превращена в работу.
А) əW= - dF
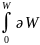 -
-
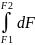
Б) əW< - dF максимальная работа которая может совершаться в изолированном процессе
dF= dU - TdS ΔF=ΔU - TdS
=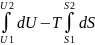 WV
- ΔF
WV
- ΔF
В закрытых системах находящихся в изохорноизотермических условиях самопроизвольно могут протекать процессы, которые сопровождаются свободной энергией Гейм-Гольца причём пределом их протекания тоесть условием равновесия является достижение некоторого минимального значенияпри данных условиях
А) ΔF < 0 Б) ΔF=0
Таким образом свободная энергия Гейм-Гольца является критерий напр. проц. в закрытой системах. Определим зависимость свободной энергии Г-Г от термодинамических параметров.
dF=(əQ/əV)TdV + (əF/əT)VdT (1)
dF=dU – TdS – SdT (2)
dU=TdS – pdV (3)
Решим совмесно уровнение (2) и (3)
dF= - pdV – SdT (4)
Сопоставим уравнение (1) и (4)
(əF/əV)T= - p
(əF/əT)= - S (5)
Из формулы (5) => энтропия является мерой убыли свободы Г-Г при нагревании в условиях постоянного объёма.
А давление мерой убыли свободной энергии Г-Г с ростом V при постоянной Т.
18.Свободная энергая Гиббса
Близкой к изохорно изотермическому потенциалу в условиях постоянного давления и температуры является изобарно изотермический потенциал или свободная энергия Гиббса.
p,T=const
əQ=dU+pdV TdS – dU – pdV=0 d(TS – U – pV)=0 d(U – pV – TS)=0 d(F – pV)=0
G=F+pV и з о б а р н о и з о т е р м и ч е с к и й п о т е н ц и а л
Изобарно изотермический потенциал является полным дифференциалом функции значение которой = 0
G= F + pV G= - Wp F = - WV WP – максимальная полезная работа которая может совершаться в изотермических условиях
ΔG= ΔF + pΔV
WP=WV – pΔV максимальная полезная работа=максимальной работе WV за вычетом работы против внешнего давления.
WP ΔG
В системах находятся при постоянном давлении и температуре, самопроизвольно могут протекать процессы которые сопровождаются уменьшением свободной энергией Гиббса причём пределом их протекания является достаточно некоторое минимальное значение
ΔG<0 ΔG=0 система находится в состоянии равновесия
G=f(p,T)
dG=(əG/əp)Tdp+(əG/əT)TdT
G=U – TS + pV
dG=dU – TdS – SdT +pdV+Vdp
dU=TdS – pdV
dG=TdS – pdV – TdS – SdT +pdV +Vdp
dG= - SdT +Vdp (2)
Решим совмесно уровнения (2) и (1)
(əG/əT)P= - S
(əG/əT)T=V (3)
Из выражения (3) => что энтропия мера убыли свободной энергии Гиббса при изобарном нагревании системы (p=const), а объём мера воздействия свободной энергии Гиббса при изотермическом повышении давлении (Т=const)/
