
- •1) Внутренняя энергия – функция состояния системы. 1 закон термодинамики.
- •2. Связь с термодинамическими параметрами
- •3) Энтальпия
- •4) Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процесс).
- •5) Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процесс).
- •6) Теплоемкость и ее зависимость от температуры
- •7) Закон Гесса – основной закон термохимии.
- •8) Уравнение Кирхгоффа в дифференциальной форме.
- •9) Уравнение Кирхгоффа в интегральной форме.
- •11. Работа обратимого и необратимого процессов
- •12.Цикл Карно
- •13. Энтропия обратимых процессов.
- •14. Энтропия не обратимых процессов.
- •15. Статический смысл энтропии.
- •16. Вычисление изменения энтропии в различных термодинамических процессах
- •17. Свободная энергия Геймгольца
- •18.Свободная энергая Гиббса
- •19 Уравнение Гибса-Гельмгольца
- •20 Понятие о химическом потенциале
- •21. Химический потенциал идеального и реального газов. Летучесть
- •22 Закон действующих масс. Константа равновесия
- •23 Изотерма химической реакции Ван Гоффа.
- •24 Уравнение изобары Вант Гоффа
- •25 Уравнение изохоры Вант Гоффа
- •26 Теорема Нернста 3 закон термодинамики
- •27 Постулат Планка
7) Закон Гесса – основной закон термохимии.
Термохимия позволяет применить первый закон термодинамики к различным химическим процессам. Она изучает химические процессы сопровождающие тепловыми…….
Теоретической и экспериментальной основой являются первый закон термодинамики.
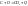
1)исходные вещества U1
2)продукты реакции
Сущность химической реакции заключается в том, что связи между атомами а молекуле исходного вещества разрушает и обрывает и разрушает связи в молекулах продуктов реакции с другой энергией.
Разница между ними будет определятся величиной теплового эффекта реакции.
Тепловой эффект реакции – это количество тепла, которое выделяется или поглощается в процессе реакции при превращении 1 моль исходного вещества.
Правило знаков принятых в термодинамике.
экзотермическая -∆H -∆U
эндотермическая ∆H ∆U
Таким
образом химическую реакцию можно
представить как термодинамический
процесс и представить как второе начало
термодинамики
 .
.
Определяем при каких условиях тепловой эффект реакции является функцией состояния системы условия.
1)
p
или v=const,
тогда
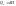

2)в
системе совершается только механическая
работа расширения
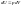
3) температура вещества и продуктов являются величиной состояния. Необходимо учитыватьразность теплот исходных продуктов и постоянных веществ.
Вывод: при данных условиях тепловой эффект является функцией состояния и не зависит от пути перехода. В этом заключается сущность закона Гесса.
Если
из данных исходных веществ можно
получить конечные продукты разными
путями то суммарная теплота процесса
на одном пути равна суммарное теплоте
процесса на другом пути.

Закон Гесса позволяет определить тепловой эффект неизвестной реакции , комбинируя реакции, тепловой эффект которых известен.
Так как невозможно определить абсолютное значение энтальпии и внутренней энаргии в термохимии вводится стандартные теплоты образования и сгорания.
Стандартная
теплота образования – теплота образования
1 моль данного соединения из простых
веществ при стандартных условиях.

для
органических соединений пользуются
стандартными теплотами сгорания – это
тепловой эффект который наблюдается
при полном сгорании 1 моль вещества в
атмосфере кислорода до простых веществ
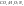 при
стандартных условиях.
при
стандартных условиях.
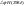 кДж/моль
кДж/моль
Из закона Гесса вытекает 2 следствия:
1) Тепловой эффект реакции равен суммы теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ.
2)Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом теплот сгорания продуктов реакции. ∆H = Σ∆Hсгор.исх. – Σ∆Нсгор.прод.
На
практике химические процессы как
правило осуществляются в изобарных
условиях, а теоретические расчеты
необходимо тоже осуществлять для
изохорных условиях.


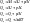
∆n – изменение числа моль.
анализ
данного уравнения: если ∆n=0
то
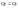
для реакции с участием твердых и жидких веществ изменением их числа моль можно пренебречь. n1=n2
