
- •1) Внутренняя энергия – функция состояния системы. 1 закон термодинамики.
- •2. Связь с термодинамическими параметрами
- •3) Энтальпия
- •4) Приложение первого закона термодинамики к идеальным газам (изохорный, изобарный процесс).
- •5) Приложение первого закона термодинамики к идеальным газам (изотермический, адиабатический процесс).
- •6) Теплоемкость и ее зависимость от температуры
- •7) Закон Гесса – основной закон термохимии.
- •8) Уравнение Кирхгоффа в дифференциальной форме.
- •9) Уравнение Кирхгоффа в интегральной форме.
- •11. Работа обратимого и необратимого процессов
- •12.Цикл Карно
- •13. Энтропия обратимых процессов.
- •14. Энтропия не обратимых процессов.
- •15. Статический смысл энтропии.
- •16. Вычисление изменения энтропии в различных термодинамических процессах
- •17. Свободная энергия Геймгольца
- •18.Свободная энергая Гиббса
- •19 Уравнение Гибса-Гельмгольца
- •20 Понятие о химическом потенциале
- •21. Химический потенциал идеального и реального газов. Летучесть
- •22 Закон действующих масс. Константа равновесия
- •23 Изотерма химической реакции Ван Гоффа.
- •24 Уравнение изобары Вант Гоффа
- •25 Уравнение изохоры Вант Гоффа
- •26 Теорема Нернста 3 закон термодинамики
- •27 Постулат Планка
1) Внутренняя энергия – функция состояния системы. 1 закон термодинамики.
1. Из закона сохранения энергии следует, что переход термодинамической системы из одного состояния в другое можно характеризовать изменением внутренней энергии системы.
Термодинамические системы являются макроскопическими. Они состоят из большого количества микрочастиц. Чтобы не рассматривать изменения энергии микрочастицы вводятся суммарная энергия всех частиц, которая называется внутренней энергией. Внутренняя энергия – это сумма кинетической энергии движения частиц (молекул, атомов, электронов) и потенциальная энергия межмолекулярного взаимодействия. Это общий запас энергии системы за вычетом кинетической и потенциальной энергии системы в целом.
∆U=U2-U1
Определить абсолютного значения U2 и U1 невозможно, изменения внутренней энергии обладают экстенсивными свойствами, т.е. ее величина будет зависеть от количества вещества.
В термодинамике принято, что внутренняя энергия является функцией состояния системы, следовательно, ее значение определяется величинами термодинамических параметров и не зависит от пути периода системы из одного состояния в другое.
С математической точки зрения внутренняя энергия является полным дифференциалом функции.
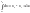
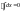

2.Является следствием 1 закона сохранения энергии и устанавливает эквивалентность перехода энергии из одного вида в другой.
-Все виды энергии переходят друг в друга в строго эквивалентных отношениях, не теряется и не возникает из ничего.
-Невозможно создать вечный двигатель первого рода, который производил бы работу без заданного эквивалентного количества энергии другого вида.
Количество тепла, подводимое в термодинамическую систему идет на увеличение внутренней энергии и на совершение системой работы.
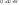
(1) - математическое выражение первого закона термодинамики в интегральном виде.
Для
малых величин используется дифференциальная
форма.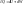 (2)Теплота
и работа в общем случае не являются
функциями состояния т.к. они определяют
процесс перехода системы (являются
функциями процесса)
(2)Теплота
и работа в общем случае не являются
функциями состояния т.к. они определяют
процесс перехода системы (являются
функциями процесса)
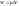
Анализ выражения 1 и 2
1) W=0 Q=∆U при отсутствии всех видов работы тепло, подводимое к системе, идет на увеличение ее внутренней энергии, которая реализуется как увеличение энергии движения молекул, атомов, электронов и т.д.
2) Q=0 W=-∆U если в систему не подается тепло, то система совершает работу за счет убыли ее внутренней энергии. Для определения величин входящих в выражения 1,2 их необходимо связать с термодинамическими параметрами системы.
2. Связь с термодинамическими параметрами
а)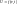
б)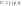
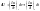
(3)Решим совместно уравнение 1 и 3. В системе совершается только механическая работа расширения газов.
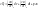
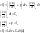
СV- теплоемкость определяется при V=const.
Теплота изотермического расширения тел.
Количество тепла, которое необходимо сообщить системе при t=const для увеличения объема на единицу измерения в отсутствии химической реакции.
определим взаимосвязь
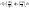
(5)решим совместно уравнения 1 и 5
V=const
dV=0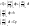

(6)Cp- теплоемкость определяется при p=const
h- (теплота изотермического возрастания p(всегда отрицательна)) - это количество тепла которое нужно отвести от системы чтобы при постоянной температуре и составе увеличить давление на единицу в процессе сжатия.
LT, h, СV, Cp - называются калорическими коэффициентами.
Полученные коэффициенты в уравнении 4 и 6 позволяют выразить выделяемое (поглощаемое) системой количество тепла через термодинамические параметры, значение которых можно определить экспериментально.
