
- •4. Составить уравнения окислительно-восстановительных реакций. Указать окислитель и восстановитель.
- •5. Сколько соли и воды надо взять для приготовления раствора?
- •5. Сколько соли и воды надо взять для приготовления раствора?
- •5. Сколько соли и воды надо взять для приготовления раствора?
- •2Почвенная коррозия.
- •5. Сколько соли и воды надо взять для приготовления раствора?
- •5. Сколько соли и воды надо взять для приготовления раствора?
- •5. Сколько соли и воды надо взять для приготовления раствора
- •5. Сколько соли и воды надо взять для приготовления раствора?
- •2. 1 Если в результате реакции выделяется малодиссоциирующее вещество – вода.
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •5. Сколько соли и воды надо взять для приготовления раствора?
5. Сколько соли и воды надо взять для приготовления раствора
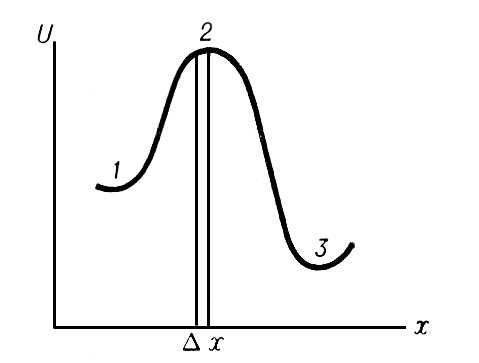
1 Активированный комплекс, группировка атомов в решающий момент элементарного акта химической реакции. Понятием об А. к. широко пользуются в теории скоростей химических реакций.
Рассмотрим пример:
H2+I2 = 2HI
При сближении молекул H2 и I2 на расстояние, сравнимое с молекулярными размерами, они отталкиваются друг от друга с силой, быстро растущей при уменьшении расстояния. Подавляющее большинство столкновений молекул H2 и I2 в газовой смеси не приводит к реакции, потому что энергия теплового движения молекул оказывается недостаточной для преодоления отталкивания. У малой доли молекул интенсивность теплового движения случайно много больше средней; этим создаётся возможность настолько тесного сближения молекул H2 и I2, что возникают новые химические связи между атомами Н и I, а существовавшие прежде химические связи Н—Н и I—I разрываются. Две образовавшиеся молекулы HI отталкиваются друг от друга и поэтому расходятся, чем завершается элементарный акт реакции. Переход от расположения связей к расположению происходит не внезапно, а постепенно: по мере сближения молекул H2 и I2 связи Н—Н и I—I ослабевают и одновременно усиливаются связи Н—I. Отталкивание Н—Н от I—I сменяется отталкиванием Н—I от Н—I в момент, когда новое расположение связей начинает превалировать над старым. Таким образом, в ходе элементарного акта возникает конфигурация атомов, являющаяся критической в том смысле, что если она достигнута, то дальнейшее движение атомов происходит беспрепятственно, не требуя запаса энергии. Совокупность атомов в этой конфигурации и называется "активированным комплексом" или "переходным состоянием"
 (график
рисовать обязательно!!!!!)
(график
рисовать обязательно!!!!!)
Дельта х и есть активированный кмплекс
Механизм химической реакции – совокупность простых реакций (стадий), по которым протекает реакция.
ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ, происходят при столкновениях ионов с молекулами или атомами в газовой фазе. Различают три группы: бимолекулярные с переходом электрона; бимолекулярные с переходом тяжелой частицы (Н, Н + , Н- или мол. фрагмента, состоящего из нескольких атомов); тримолекулярные. Первая группа включает реакции перезарядки и отрыва электрона от отрицат. ионов.
Аr+ +CH4 : CH3+ + Аr + H
ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ-м. р. с переходом тяжелой частицы: СН4+ + СН4 : СН5+ + СН3; Не+ + Н2 : НеН+ + Н; SO2+ + SO2 : S2O3+ + О; NH4 * H2O + NH3 : H+(NH3)2 + + H2O. Тримолекулярные ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ-м. р. - это, как правило, реакции прилипания нейтральной частицы к иону, в результате чего образуются так называемой ионные кластеры:
O2+ + O2 + M : O2+ * O2 + M;
О2 - + О2 + М : О2 - * О2 + М
(М - третья частица).
2 Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз – это обратимый процесс.
Виды гидролиза:
1 По катиону:
NH4C1+ НОН = NH4OH + HC1
Водные растворы этих солей имеют кислую реакцию.
2 По аниону:
NaClO + НОН= NaOH +НClO
Водные растворы этих солей имеют щелочную реакцию.
3 Совместный по катиону и аниону:
NН4СlO+ НОН = NН4ОН+ НСlO
Водные растворы таких солей имеют нейтральную, кислую или щелочную реакцию в зависимости от величины констант электролитической диссоциации.
Усилить или подавить гидролиз можно тремя способами:
1) прибавлением к раствору соли кислоты, щелочи или какого-либо другого гидролизующегося электролита;
2) изменением концентрации раствора соли;
3) повышением или понижением температуры раствора соли. Гидролиз соли типа NH4C1 можно схематически изобразить
следующим образом
NH4C1+ НОН= NH4OH +НС1 НС1+ Н С1-
Течение реакции слева направо тормозится образованием ионов водорода, нейтрализующих NH4OH и смещающих подвижное равновесие справа налево.
Чтобы усилить гидролиз соли, образованной катионом слабого основания и анионом сильной кислоты, необходимо добавить основание для связывания получающихся в процессе гидролиза ионов водорода.
При добавлении основания произойдет нейтрализация соляной кислоты, и динамическое равновесие сдвинется вправо, т. е. гидролиз усилится. Если же к раствору гидролизующейся соли типа NH4C1 прибавить кислоты, то гидролиз затормозится.
3 Электроли́т — вещество, расплав или раствор, которое проводит электрический ток вследствие диссоциации на ионы.
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как:HCl, HBr, HI, HNO3).
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации α равна отношению числа диссоциированных молекул n к общей сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать изотонический коэффициент для них равнен количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Изотонический коэффициент показывает, насколько в растворе электролита больше частичек по сравнению с раствором неэлектролита аналогичной концентрации. Однако в действительности этот коэффициент всегда меньше определённого по формуле. (Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0, (для раствора сульфата магния той же концентрации и вовсе i = 1,3)). Это объясняет теория сильных электролитов П. Дебая и Э. Хюккеля: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют кажущуюся степень диссоциации сильных электролитов, также обозначаемую через α:
![]() ,
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учетом различных взаимодействий между ними в растворе, то есть с учетом отклонения поведения системы от модели идеального раствора.
Количественные расчеты характеристик растворов сильных электролитов осуществляют с помощью активности электролита аэ и активностей катионов и анионов а+ и а- соответственно, которые равны произведению коэффициента активности на концентрацию:
![]()
![]()
![]()
Коэффициент активности f служит мерой отклонения поведения раствора (или компонента раствора) от идеального.
Размерность и величина активности зависит от используемого способа выражения концентрации — если ax (активность при выражении концентрации как мольной доли) величина безразмерная, то и ac am (для молярности и моляльности соответственно) — размерные величины, выражаются в моль/л и моль/кг.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
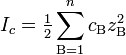 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 10
1. Возникновение электродных потенциалов. Уравнение Нернста. Электрохимический ряд металлов.
2. Условия протекания ионных реакций.
3. Железо. Природные соединения, получение, очистка. Свойства железа и его соединений.
4. Составить уравнения окислительно-восстановительной реакции. Укажите окислитель и восстановитель.
