
- •1. Строение атома
- •1.1. Энергетическое состояние электронов в атоме
- •1.2. Основные принципы распределения электронов в атомах
- •В соответствии с этим правилом последовательность заполнения подуровней:
- •1.3. Периодический закон и электронные формулы атомов
- •1.4. Примеры решения и оформления заданий
- •1.5. Задания для самостоятельной подготовки
- •2. Классы неорганических веществ
- •2.1. Оксиды
- •Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •2.2. Гидроксиды
- •Основания
- •Кислоты
- •Амфотерные гидроксиды
- •2.3. Соли
- •Средние соли
- •Кислые соли
- •Основные соли
- •2.4. Примеры решения заданий
- •2.5. Задания для самостоятельной подготовки
- •3. Основы химической термодинамики
- •3.1. Энтальпия
- •3.2. Энтропия
- •3.3 Энергия Гиббса и ее изменение в ходе химических реакций
- •3.4. Примеры решения заданий
- •3.5. Задания для самостоятельной подготовки
- •4. Химическое равновесие
- •4.1. Константа химического равновесия
- •4.2. Принцип Ле Шателье
- •Влияние концентраций компонентов системы
- •Влияние температуры
- •Влияние общего давления в системе
- •4.3 Примеры решения заданий
- •4.4. Задания для самостоятельной подготовки
- •5. Растворы
- •5.1. Примеры решения заданий
- •5.2. Задания для самостоятельной подготовки
- •5.3. Электролиты
- •Теория электролитической диссоциации Степень диссоциации
- •5.4. Ионные реакции
- •5.5. Примеры решения заданий
- •5.6. Задания для самостоятельной подготовки
- •5.7. Диссоциация воды. Водородный показатель
- •5.8. Гидролиз
- •5.9. Примеры решения заданий
- •5.10 Задания для самостоятельной подготовки
- •6. Окислительно-восстановительные процессы
- •6.1. Степень окисления
- •6.2. Окислительно-восстановительные реакции
- •6.3. Составление уравнений окислительно-восстановительных реакций
- •Правила составления полуреакций в разных средах
- •Овр в кислой среде
- •Овр в щелочной среде
- •Овр в нейтральной среде
- •6.4. Примеры решения заданий
- •6.5. Задания для самостоятельной подготовки
- •6.6 Взаимодействие металлов с кислотами, водой и растворами щелочей
- •6.7. Примеры решения и оформления заданий
- •6.8. Задания для самостоятельной подготовки
- •6.9. Электрохимическая коррозия
- •Описание процесса гальванокоррозии
- •6.10. Примеры решения заданий
- •6.11. Задания для самостоятельной подготовки
- •6.12. Электролиз растворов
- •Катодные процессы
- •Анодные процессы
- •Законы фарадея
- •6.13. Примеры решения и оформления заданий
- •6.14 Задания для самостоятельной подготовки
- •Библиографический список Основная литература
- •Дополнительная литература
- •Стандартные энтальпии образования и энтропии
- •Названия некоторых кислот и их солей
- •Стандартные окислительно-восстановительные потенциалы металлов
- •Окислительно-восстановительные потенциалы водорода, кислорода и металлов в разных средах оглавление
5. Растворы
Раствор – однородная многокомпонентная система переменного состава, состоящая из растворителя, растворенных веществ и продуктов их взаимодействия.
Существует несколько способов выражения состава раствора.
Массовая доля растворенного вещества (С). Это отношение массы растворенного вещества (mВ) к массе раствора (m). Это отношение может быть выражено в долях единицы или в процентах:
![]() (1)
(1)
![]() (2)
(2)
Молярная концентрация раствора (СM, моль/л, М) это отношение количества растворенного вещества (νВ) к объему раствора (V)
![]() (3)
(3)
![]() (4)
(4)
5.1. Примеры решения заданий
Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?
![]()
 • Масса
1 л раствора равна
• Масса
1 л раствора равна
ρ p=1,105
г/мл
p=1,105
г/мл
![]()
CM –? • Рассчитаем массу Al2(SO4)3 в 1105 г раствора, исходя из формулы (1):
![]()
• Молярная
масса
![]() ,
следовательно, молярная концентрация
сульфата алюминия исходя из формулы
(4):
,
следовательно, молярная концентрация
сульфата алюминия исходя из формулы
(4):
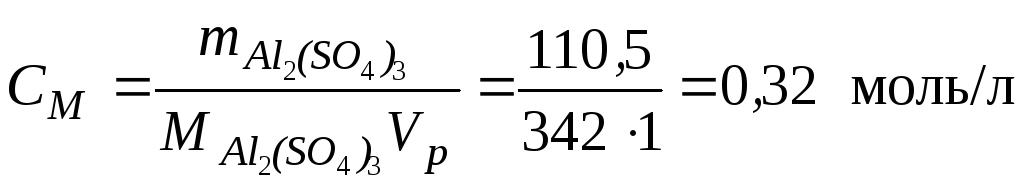
Пример 2. Чему равна массовая доля 0,2 М раствора (NH4)2SO4 с плотностью 1,015 г/мл?
![]()
 • Масса
1 л раствора равна
• Масса
1 л раствора равна
ρ p=1,015
г/мл
p=1,015
г/мл
![]()
![]() – ?
• Рассчитаем массу (NH4)2SO4
в 1 л
раствора,
– ?
• Рассчитаем массу (NH4)2SO4
в 1 л
раствора,
используя
формулу (4) (молярная масса
![]() ):
):
![]()
• Массовая доля сульфата алюминия в растворе по формуле (1) :
![]()
Пример 3. Смешали 50 мл 10 %-го раствора серной кислоты плотностью 1,069 г/мл и 150 мл 30 %-го раствора той же кислоты, плотностью 1,224 г/мл. Чему равна массовая доля кислоты в конечном растворе?
Условная схема приготовления конечного раствора:
раствор 1 (10 %) + раствор 2 (30 %) = раствор 3 (? %)
![]()
 • Массовая
доля серной кислоты, исходя из (1):
• Массовая
доля серной кислоты, исходя из (1):
ρp1=1,069
г/мл
![]()
Vp1= 50 мл • Исходя из того, что масса конечного раствора складывается
![]() из
масс исходных растворов, а масса
растворенной в нем
из
масс исходных растворов, а масса
растворенной в нем
ρp2=1,224 г/мл кислоты – из масс кислоты в исходных растворах, получаем:
V p2=
150 мл
p2=
150 мл
![]()
![]() • Используя
значения плотностей растворов и выражение
(1), найдем массы исходных растворов и
растворенной в них серной кислоты:
• Используя
значения плотностей растворов и выражение
(1), найдем массы исходных растворов и
растворенной в них серной кислоты:
![]()
![]()
![]()
![]()
• Найдем массовую долю серной кислоты в конечном растворе:
![]() .
.
Пример 4. Какой объем 40 %-го раствора азотной кислоты плотностью 1,251 г/мл и воды потребуется для приготовления 500 мл 20 %-ой кислоты плотностью 1,119 г/мл?
Условная схема приготовления раствора:
раствор 1 (40 %) + вода = раствор 2 (20 %)

![]() • Необходимый
объем
исходного
раствора
кислоты выразим из (2):
• Необходимый
объем
исходного
раствора
кислоты выразим из (2):
ρp1=1,251
г/мл
![]()
![]() • В
полученном выражении неизвестна масса
кислоты, но при
• В
полученном выражении неизвестна масса
кислоты, но при
ρp2=1,119 г/мл разбавлении исходного раствора водой масса растворенной
V p2=
500 мл кислоты не изменяется, поэтому
ее можно вывести из
p2=
500 мл кислоты не изменяется, поэтому
ее можно вывести из
Vp1– ? мл выражения массовой доли раствора 2:
![]()
![]()
• Рассчитаем объем исходного раствора:
![]()
• Исходя из схемы получения конечного раствора:
![]()
Пример 5. Какой объем 10 %-го раствора КОН плотностью 1,082 г/мл потребуется для приготовления 2 л 1 М раствора?
Условная схема приготовления раствора:
раствор 1 (10 %) + вода = раствор 2 (1 М)

![]() • Необходимый
объем
исходного
раствора
кислоты выразим из (2):
• Необходимый
объем
исходного
раствора
кислоты выразим из (2):
ρp1=1,082
г/мл
![]()
![]() • В
полученном выражении неизвестна масса
щелочи, но при
• В
полученном выражении неизвестна масса
щелочи, но при
V p2=
2 л разбавлении исходного
раствора водой масса растворенной
p2=
2 л разбавлении исходного
раствора водой масса растворенной
Vp1– ? мл щелочи не изменяется, поэтому ее можно вывести из
выражения молярной концентрации раствора 2:
![]() ;
;
![]()
• Рассчитаем объем исходного раствора:
![]()
