
- •Биосинтез рнк: строение промоторов, взаимодействие рнк-полимеразы с промоторами.
- •Характеристика рнк-полимераз у про- и эукариот.
- •Этапы биосинтеза рнк: инициация, элонгация, терминация.
- •Инициация
- •Элонгация.
- •Терминация.
- •Компоненты белоксинтезирующей системы у прокариот: мРнк, рРнк, тРнк; белковые факторы инициации, элонгации и терминации; 70s рибосомы.
- •Компоненты белоксинтезирующей системы эукариот (мРнк, рРнк, тРнк; мяРнк, белковые факторы инициации, элонгации и терминации; 80s рибосомы).
- •Строение рибосом, характеристика функциональных центров.
- •Биосинтез белка: активация аминокислот. Характеристика аминоацил-тРнк-синтетаз.
- •Инициация трансляции в прокариотических клетках.
- •46. Элонгация и терминация трансляции прокариот.
- •47. Генетический код. Основные характеристики.
- •Характеристика этапов трансляции в эукариотических клетках.
- •Сворачивание (фолдинг) полипептидной цепи. Роль ферментов и шаперонов в этом процессе.
- •Посттрансляционные модификации белков (из интернета).
- •1.Динамическая биохимия. Характеристика метаболических путей
- •1.1 Характеристика метаболических путей
- •2. Распад углеводов в желудочно-кишечном тракте. Роль амилолитических ферментов.
- •2.1 Расщепление углеводов в пищеварительном тракте
- •5. Трегалаза (не давала в лекции)
- •В последующей реакции, катализируемой ферментом фосфоенолпируваткарбоксикиназой, из оксалоацетата образуется фосфоенолпируват. Реакция Mg2-зависимая и донором фосфата служит gtp.
- •5. Окислительное декарбоксилирование пирувата. Строение пируватдегидрогеназного комплекса, регуляция активности.
- •6.Цикл лимонной кислоты. Регуляция цикла.
- •7.Дыхательная цепь: организация компонентов в виде 4-х белковых комплексов. Характеристика дыхательных переносчиков (fmn, железосерные белки, убихиноны, цитохромы).
6.Цикл лимонной кислоты. Регуляция цикла.
в матриксе митохондрий


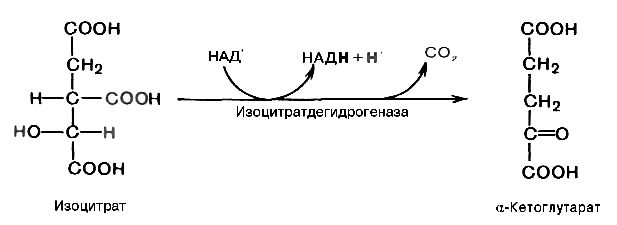
NAD+-зависимая изоцитратдегидрогеназа является аллостерическим фе
рментом которому в качестве специфического активатора необходим ADP
(аденозиндифосфат)




На первом этапе пируватдегидрогеназный комплек с активируется пируватом, NAD+, СоА; ингибируется NADH и ацетил-СоА; на втором этапе цитратсинтазная реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADH, АТP и сукцинил-СоА; на третьем этапе изоцитратдегидрогеназа аллостерически активируется АDP, ионами кальция, ингибируется NADH; на четвёртом этапе - кетоглутаратдегидрогеназный комплекс ингибируется NADH, АTP и сукцинил-СоА, активируется ионами кальция.
7.Дыхательная цепь: организация компонентов в виде 4-х белковых комплексов. Характеристика дыхательных переносчиков (fmn, железосерные белки, убихиноны, цитохромы).
Цепь переноса электронов и протонов внутренней мембраны митохондрий.
Последовательность реакций, связанных с переносом водорода на кислород при участии специфических переносчиков электронов, называется дыхательной (и
ли электронтранспортной) цепью. Основные переосчики электронов дыхательной цепи организованы в 4 комплекса. Пространственное расположение компонентов таково, что оно облегчает их функционирование и соответствует возрастанию окислительно-восстановительного потенциала.
Три комплекса – I, III и IV –протонные помпы, т.е. используя энергию электронов, эти комплексы обеспечивают перенос Н+ из матрикса в межмембранное пространство. В результате возникает протонный электрохимический потенциал. Комплекс II катализирует окисление сукцината убихиноном.Комплекс 1 NADH-дегидрогеназа катализирует окисление NADH убихиноном. Реакция сопровождается трансмембранным переносом 4-х протонов при окислении одной молекулы NADH (2 электрона) и генерацией на сопрягающей мембране митохондрий разности электрохимических потенциалов. 46 субъединиц.
Комплекс 2 катализирует окисление сукцината убихиноном. Он состоит из 4 субъединиц: флавинопротеина,железосерного белка, идвух гидрофобных заякоренных субъединиц. Флавинопротеид содержит ковалентно связанный флавинмононуклеотид. Железосерные белки – это три различных железосерных кластера: [2Fe-2S] – центр S1; [3Fe-4S] – центр S2; [4Fe-4S] – центр S3. Две субъединицы являются цитохромом b и убихинон-связывающим белком. Комплекс 3 четыре редокс-центра: гемы bl и bh, связанные с цитохромом b; негемовый железосерный кластер FeSIII; включеный в соответствующий апопротеин; гем с, присоединенный к апопротеину цитохрома с1 . Наряду с переносчиками восстановительных эквивалентов в состав комплекса входит 8 полипептидов, лишенных простетиеских групп. Функционирует комплекс III по типу Q-цикла. Участвует в генерации протонного градиента, перенося 2 протона водорода из матрикса в межмембранное пространство.
Комплекс 4 Цитохромоксидаза катализирует окисление восстановленного цитох
рома с молекулярным кислородом. содержит 4 редокс-центра: 2 гема а-типа (а и а3) и 2 атома меди (CuA и CuB). содержит 3 крупные субъединицы, кодируемых митохондриальной ДНК, и еще 9 мелких субъединиц, синтезируемых в цитоплазме. частично погружена в мембрану, а частично экспонирована в воду.
Между комплексами электроны переносятся с помощью подвижных переносчиков: убихинона и цитохрома с. Двигаясь диффузно через липидный бислой мембраны, убихинон связывает комплексы I и III. Цитохром с выполняет аналогичную челночную функцию на участке между комплексами III и IV, диффундируя вдоль поверхности мембраны. Функцию коллектора восстановительных эквивалентов в дыхательной цепи выполняют NAD+ и убихинон. Если редокс-потенциал субстрата значительно ниже, чем у NAD+, восстановительные эквиваленты переносятся на средний или конечный участок дыхательной цепи.
Переносчики электронов:Способность молекулы принимать электроны
оценивается по величине окислительно-восстановительного потенциала (Е) Е0 (нормальный потенциал)
1 флавиновые коферменты: флавинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD). В составе специфических дегидрогеназ (флавиновых ферментов или флавопротеинов) выполняют роль простетической группы, участвующей в переносе электронов. Активной частью молекулы FAD или FMN служит изоаллоксазиновое кольцо рибофлавина. FMN и FAD прочно связаны с соответствующими дегидрогеназными белками и не могут свободно переносить восстановительные эквиваленты путем диффузии к другим дегидрогеназным системам. флавопротеины могут акцептировать водород от NADH
2 бензохиноновым соединением, носящим названиие кофермента Q, или убихинона. При восстановлении он присоединяет два электрона и два протона, образуя гидрохиноновую форму CoQH2. СoQ способен принимать водород от различных флавопротеинов. Система СoQ представляет собой узловой пункт, куда стекается водород, поступающий в дыхательную цепь от самых различных субстратов. Хорошая растворимость в липидной фазе мембранных образований и относительно небольшой молекулярный вес придают СoQ свойство подвижного переносчика, взаимодействующего с фиксированными электронпереносящими белками.
3 от СoQ на кислород представлен группой различных гемсодержащих белков (гемопротеинов), называемых цитохромами. Отличаясь друг от друга структурой белкового компонента, все они имеют простетическую геминовую группу, по строению близкую к гему гемоглобина. Цитохромы переносят электроны последовательно от СoQ на конечный акцептор – кислород. На участке NADH и СoQ осуществляется двухэлектронный перенос, цитохромы переносят по одному электрону. При этом происходит обратимое окисление-восстановление атома железа простетической группы, переходящеео из Fe2+ в Fe3+. Следовательно, на данном участке цепи должны действовать две молекулы цитохромов.
цит.b → цит.с1 → цит.с → цит.а → цит.а3 → О2
а)CoQH2 + 2Fe3+ - цит.b → CoQ + Fe2+ - цит.b + 2H+
б)2Fe2+ - цит.b + 2Fe3+ - цит.с → 2Fe3+ - цит.b + Fe2+ - цит.с
в)2Fe2+ - цит. а3 + 2Н+ + ½ О2 → 2Fe3+ - цит. а3 + Н2О
«Активный» кислород присоединяет два протона из окружающей среды, образуя воду. В этой реакции кислород, кАк наиболее сильный окислитель, акцептируя электроны, создает основную движущую силу для переноса электронов вдоль дыхательной цепи, в результате чего все выше расположенные переносчики поддерживаются в окисленном состоянии и оказываются способными приниматьводород и электроны, поставляемые от окисляемых субстратов.
4 В транспорте электронов принимают участие белки (ферредоксины), содержащие негемовое железо, в молекуле которых железо связывается с белком-носителем через атом серы. Отличительная особенность FeS-белков – строение их активного центра, содержащего неемовое железо, связанное нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Разные типы железосероцентров (FeS-центры) широко распространены в клетках. В зависимости от особенностей строения FeS-центров ферредоксины могут одновременно переносить один или два электрона. Все компоненты дыхательной цепи локализуются на внутренней мембране митохондрий и включены в состав белковых комплексов.
