
Билет № 24
1. Дайте определение энтальпии (H), энтропии (S), потенциала Гиббса (G) и понятиям их стандартных величин.
Энтальпия
системы (от греч. enthalpo
нагреваю), тепловой эффект реакции,
измеренный при постоянном давлении,
связана с внутренней энергией U
соотношением
![]() где V
- объем системы.
где V
- объем системы.
В химии чаще всего рассматривают изобарические процессы (Р = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
![]()
Энтальпия
имеет размерность энергии (кДж). Ее
величина пропорциональна количеству
вещества; энтальпия единицы количества
вещества (моль) измеряется в кДж*моль-1.
В
термодинамической системе выделяющуюся
теплоту химического процесса условились
считать отрицательной (экзотермический
процесс,
![]() <
0), а поглощение системой теплоты
соответствует эндотермическому процессу,
<
0), а поглощение системой теплоты
соответствует эндотермическому процессу,
![]() > 0.
> 0.
Энтропия
(S)
- термодинамическая функция состояния,
которая служит мерой беспорядка
(неупорядоченности) системы. Возможность
протекания эндотермических процессов
обусловлена изменением энтропии, ибо
в изолированных системах энтропия
самопроизвольно протекающего процесса
увеличивается
![]() > О (второй закон термодинамики).Энтропия
вещества или системы тел при определенной
температуре является абсолютной
величиной. Л. Больцман определил энтропию
как термодинамическую вероятность
состояния (беспорядок) системы W.
Поскольку число частиц в системе велико
(число Авогадро NА = 6,02*1023), то энтропия
пропорциональна натуральному логарифму
термодинамической вероятности состояния
системы W:
> О (второй закон термодинамики).Энтропия
вещества или системы тел при определенной
температуре является абсолютной
величиной. Л. Больцман определил энтропию
как термодинамическую вероятность
состояния (беспорядок) системы W.
Поскольку число частиц в системе велико
(число Авогадро NА = 6,02*1023), то энтропия
пропорциональна натуральному логарифму
термодинамической вероятности состояния
системы W:
![]() Размерность
энтропии 1 моля вещества совпадает с
размерностью газовой постоянной К и
равна Дж-моль-1*K-1
Размерность
энтропии 1 моля вещества совпадает с
размерностью газовой постоянной К и
равна Дж-моль-1*K-1
Самопроизвольное
протекание изобарно-изотермического
процесса определяется двумя факторами:
энтальпийным, связанным с уменьшением
энтальпии системы (![]() ),
и энтропийным Т
),
и энтропийным Т![]() ,
обусловленным увеличением беспорядка
в системе вследствие роста ее энтропии.
Разность этих термодинамических факторов
является функцией состояния системы,
называемой изобарно-изотермическим
потенциалом
или свободной энергией Гиббса
(G,
кДж): При
,
обусловленным увеличением беспорядка
в системе вследствие роста ее энтропии.
Разность этих термодинамических факторов
является функцией состояния системы,
называемой изобарно-изотермическим
потенциалом
или свободной энергией Гиббса
(G,
кДж): При
![]() < 0 реакция термодинамически разрешена
и система стремится к достижению условия
< 0 реакция термодинамически разрешена
и система стремится к достижению условия
![]() = 0, при
котором
наступает равновесное состояние
обратимого процесса;
= 0, при
котором
наступает равновесное состояние
обратимого процесса;
![]() > 0 указывает на то, что процесс
термодинамически
запрещен.
> 0 указывает на то, что процесс
термодинамически
запрещен.
2. Формула расчета степени диссоциации электролита.
Важной характеристикой электролитов служит степень диссоциации а:
![]()
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, а > 30 %. К слабым относят некоторые минеральные кислоты (НNO2, НСN, Н2SОЗ), большинство оснований, практически все органические кислоты.
3. Напишите варианты реакций получения оксидов при окислении простых и сложных веществ.
2Mg + O2 = 2MgO
4P + 5O2 = 2P2O5
2ZnS + 3O2 = 2Zn + 3SO2
2H2S + 3O2 = 2SO2 + 2H2O
2CuS + 3O2 = 2CuO + 2SO2
Билет № 25
1. Химическое равновесие и принцип Ле Шателье (влияние внешних факторов).
Химическое равновесие - это такое динамическое равновесие в системе, при которой скорость прямой и обратной реакции равны.
При
известных
![]() реакции или при
реакции или при
![]() О
на химическое равновесие можно
воздействовать изменением температуры
или давления. Химическое равновесие
может быть смещено изменением концентраций
реагентов. Другими словами, равновесие
можно сместить внешним воздействием,
руководствуясь принципом Ле Шателье:
если на равновесную систему оказывать
внешнее воздействие, то равновесие
смещается в сторону, противодействующую
этому воздействию.
О
на химическое равновесие можно
воздействовать изменением температуры
или давления. Химическое равновесие
может быть смещено изменением концентраций
реагентов. Другими словами, равновесие
можно сместить внешним воздействием,
руководствуясь принципом Ле Шателье:
если на равновесную систему оказывать
внешнее воздействие, то равновесие
смещается в сторону, противодействующую
этому воздействию.
1
Влияние температуры. Для реакций, идущих
с уменьшением энтальпии (экзотермических),
повышение температуры будет препятствовать
протеканию прямого процесса, то есть
смещать реакцию в сторону исходных
веществ. Эндотермические реакции при
этом будут смещаться в сторону конечных
продуктов. Например, при обычных условиях
реакция N2 + О2 не идет (![]() > 0), но повышение температуры может
сделать эти реакцию осуществимой.
Реакция СО + 1/2О2 = СО2, АН < 0 с повышением
температуры будут смещаться в сторону
исходных веществ.
> 0), но повышение температуры может
сделать эти реакцию осуществимой.
Реакция СО + 1/2О2 = СО2, АН < 0 с повышением
температуры будут смещаться в сторону
исходных веществ.
2
Влияние давления. Если реагируют
газообразные вещества, то при неизменном
числе молей начальных и конечных
реагентов повышение общего давления
не приведет к смещению равновесия. Если
число молей при реакции меняется, то
изменение общего давления приведет к
смещению равновесия. В частности, реакция
2СО + О2 = 2С02, протекающая с уменьшением
![]() ,
при повышении общего давления сместится
в сторону образования СО2.
,
при повышении общего давления сместится
в сторону образования СО2.
3 Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот.
2. Закон разбавления Оствальда для «слабых» электролитов. Какие еще бывают электролиты?
Если
выразить равновесные концентрации
через концентрацию слабого электролита
С и его степеньдиссоциации а, то получим
![]()
Это
соотношение называют законом разбавления
Оствальда. Для очень слабых электролитов
при а « 1 это уравнение упрощается:
![]()
Тогда
![]()
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации а стремится к единице.
Классификация электролитов по степени диссоциации весьма условна. Так, согласно одной классификации, электролиты, степень диссоциации которых меньше единицы, считают слабыми электролитами, к сильным относят электролиты с α = 1 (но таких практически не бывает). По другой классификации сильными считаются электролиты с α > 0,3, слабыми – с α < 0,3. Электролиты со значением степени диссоциации 0,03 < α < 0,3 классифицируют как электролиты средней силы. При записи диссоциации следует использовать знак для диссоциации сильных электролитов и знак для диссоциации слабых электролитов (во втором случае степень диссоциации может достигать только несколько процентов или даже доли прицента).
3. Напишите варианты реакций получения оксидов при разложении солей.
CaCO3 = CaO + CO2
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Ba(NO2)2 = BaO + NO + NO2
MgCO3 = MgO + CO2
Билет № 26
1. Равновесие в гетерогенной среде (правило фаз Гиббса-Коновалова). Какие возможны «фазовые превращения» вещества?
Большинство веществ могут существовать в одном из трех агрегатных состояний: газообразном (парообразном), жидком и твердом. В определенных условиях эти фазы способны переходить друг в друга, то есть всякую жидкость путем испарения можно перевести в газ, а охлаждением - в твердое состояние. На рис. 6.9 показаны взаимные фазовые превращения вещества.
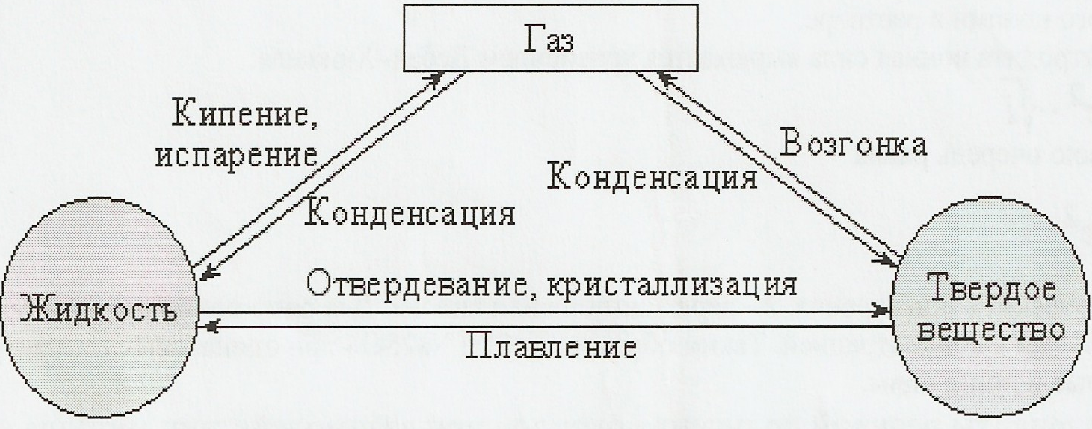
Равновесия между различными фазами одной системы называют фазовыми, а описывают эти фазовые равновесия посредством фазовых диаграмм или диаграмм состояния. Фазовая диаграмма позволяет установить условия равновесия между числом фаз, числом компонентов и числом степеней свободы (вариантностью) системы.
Фаза (Ф) - гомогенная (однородная по химическому составу и термодинамическим свойствам) часть системы, отделенная от других частей поверхностью раздела. Так, два нерастворимых друг в друге твердых вещества, как и две несмешивающиеся жидкости, образуют две фазы. Компоненты (К) - химически индивидуальные вещества, наименьшее число которых достаточно для образования фаз системы. Число компонентов определяется количеством индивидуальных веществ в системе за вычетом числа
возможных между ними обратимых взаимодействий. Например, система из трех индивидуальных веществ Н2О, Н2, О2 будет двухкомпонентной. поскольку для образования всех фаз достаточно любых двух
веществ:
![]() По
числу компонентов системы делятся на
одно-, двух-, трех- и многокомпонентные.
Степени
свободы (С) - число параметров (температура,
давление, состав системы), которые можно
произвольно
менять без изменения числа фаз в системе.
По
числу компонентов системы делятся на
одно-, двух-, трех- и многокомпонентные.
Степени
свободы (С) - число параметров (температура,
давление, состав системы), которые можно
произвольно
менять без изменения числа фаз в системе.
Правило
фаз Гиббса: в изолированной равновесной
системе число степеней свободы равно
числу
компонентов
системы плюс два минус число фаз:
![]()
Если
один из параметров системы (температура
или давление) имеет постоянное значение,
то правило фаз принимает вид:
![]() Это
уравнение используется при изучении
конденсированных систем, состоящих
только из твердых и
жидких
фаз, поскольку состояния равновесия в
таких системах малочувствительны к
изменению давления
Наибольшее
практическое значение имеют только
изобарные диаграммы двухкомпонентных
систем,
содержащие
только конденсированные фазы.
Это
уравнение используется при изучении
конденсированных систем, состоящих
только из твердых и
жидких
фаз, поскольку состояния равновесия в
таких системах малочувствительны к
изменению давления
Наибольшее
практическое значение имеют только
изобарные диаграммы двухкомпонентных
систем,
содержащие
только конденсированные фазы.
2. Уравнение Дебая-Хюккеля для ионной силы «сильного» электролита.
Дебай
и Хюккель, предложив модель, которая
легла в основу теории сильных электролитов,
постулировали:
Электролит
полностью диссоциирует, но в сравнительно
разбавленных растворах (С = 0,01 моль*л-1).
Каждый
ион окружен оболочкой из ионов
противоположного знака. В свою очередь,
каждый из этих ионо сольватирован. Это
окружение называется ионной атмосферой.
Очевидно,
что при электростатическом взаимодействии
ионов противоположных знаков необходимо
учитывать влияние ионной атмосферы.
При движении катиона в электростатическом
поле ионная атмосфера деформируется;
она сгущается перед ним и разрежается
позади него. Эта асимметрия ионной
атмосферы оказывает тем более тормозящее
действие движению катиона, чем выше
концентрация электролитов и чем больше
заряд ионов. В этих системах само понятие
концентрации становится неоднозначиным
и должно заменяться активностью. Для
бинарного одно-однозарядного электролита
KatAn
-> Каt+
+ Аn+
активности катиона (а+) и аниона (а-)
соответственно равны
![]()
где С+ и С- - аналитические концентрации соответственно катиона и аниона, у+ и у- - их коэффициенты активности.
Определить
активности каждого иона в отдельности
невозможно, поэтому для одно-однозарядных
электролитов
пользуются средними геометрическими
значений активностей и коэффициентов
активностей:
![]() Коэффициент
активности по Дебаю—Хюккелю зависит
по крайней мере от температуры,
диэлектрической проницаемости
растворителя (
Коэффициент
активности по Дебаю—Хюккелю зависит
по крайней мере от температуры,
диэлектрической проницаемости
растворителя (![]() )
и ионной силы (I);
последняя служит мерой интенсивности
электрического поля, создаваемого
ионами в растворе. Для данного электролита
ионная сила выражается уравнением
Дебая-Хюккеля:
)
и ионной силы (I);
последняя служит мерой интенсивности
электрического поля, создаваемого
ионами в растворе. Для данного электролита
ионная сила выражается уравнением
Дебая-Хюккеля:
![]()
Ионная
сила в свою очередь равна
![]() Здесь
С - аналитическая концентрация, 2 - заряд
катиона или аниона. Для однозарядного
электролита ионная сила совпадает с
концентрацией. Таким образом, NaCl
и NaS04
при одинаковых концентрациях будут
иметь разные ионные силы.
Здесь
С - аналитическая концентрация, 2 - заряд
катиона или аниона. Для однозарядного
электролита ионная сила совпадает с
концентрацией. Таким образом, NaCl
и NaS04
при одинаковых концентрациях будут
иметь разные ионные силы.
3. Напишите варианты реакций получения оксидов при взаимодействии металла с другим оксидом.
2Mg + CO2 = 2MgO + C
2Ca + CO2 = 2CaO + C
2Zn + CO2 = 2BaO + C
2Ba + CO2 = 2BaO + C
2Hg + CO2 = 2HgO + C
Билет № 27
1. Что такое «катализ» и в чем причина изменения скорости реакции при введении катализатора?
Катализ – ускорение реакции за счет введения в нее катализатора, снижающего энергию одного из участников реакции. Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными. Каталитические реакции - реакции, протекающие в присутствии катализаторов. Положительным называют катализ, при котором скоость реакции возрастает, отрицательным (ингибированием) - при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии: Н О + I = H O + IO; Н O + IO = Н O + O + I; При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела - катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы: 1. Диффузия реагирующих веществ к поверхности твердого вещества; 2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их; 3. Химическая реакция между реагирующими молекулами; 4. Десорбция продуктов с поверхности катализатора; 5. Диффузия продукта с поверхности катализатора в общий поток. Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод). Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом промоторы могут сами и не обладать каталитическими свойствами.
2. Формула ионного произведения воды.
Константу равновесия, характеризующую произведение молярных концентраций ионов H+ и ОН-, называют ионным произведением воды и обозначают KW или КH2O.
KW = [H+][OH-]
KW = 1,007·10-14
Увеличение концентрации водородных ионов вызывает соответствующее уменьшение
концентрации гидроксид-ионов, и наоборот. Равновесие между ионами Н+ и ОН- существует не только в воде, но и во всех водных растворах. Поэтому это соотношение может характеризовать кислотность и основность различных сред. Диссоциация же воды является эндотермическим процессом. Отсюда в соответствии с принципом Ле Шателье температура оказывает значительное влияние на КW
H+(p) + OH-(p) = H2O(ж)
Так как KW ≠ 0, то не может быть водного раствора, в котором концентрация Н+ или ОН-
равнялась бы нулю. Следовательно, в любом водном раствope всегда присутствуют
совместно ионы Н+ и ОН-.
В нейтральной среде
[Н+] = [ОН-] = (10-14)1/2 = 10-7 моль/л,
в кислой среде
[Н+] > 10-7 моль/л и [ОН-] < 10-7 моль/л,
в щелочной среде
[Н+] < 10-7 моль/л и [ОН-] > 10-7 моль/л.
Для характеристики кислотности (щелочности) среды можно пользоваться любой из
этих величин, так как
[Н+] = 10-14 / [ОН-] и [OH-] = 10-14 / [Н+].
Обычно кислотность и щелочность среды характеризуют концентрацией водородных ионов. Строго говоря, постоянство ионного произведения воды справедливо лишь в том случае, если аналитические концентрации ионов заменены их активностями. Это особенно важно для концентрированных водных растворов сильных кислот и оснований (для малых
концентраций H+ и ОН- значения концентрации и активности практически совпадают).
Для оценки кислотности, нейтральности и щелочности водных растворов удобно
пользоваться не концентрацией водородных ионов, а водородным показателем. Водородный показатель характеризует концентрацию свободных ионов водорода в воде. Для удобства отображения был введен специальный показатель, названный рН и представляющий собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -log[H+]. Если говорить проще, то величина рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН. pH воды - один из важнейших рабочих показателей качества воды, во многом определяющих характер химических и биологических процессов, происходящих в воде. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. Контроль за уровнем рН особенно важен на всех стадиях водоочистки, так как его "уход" в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки
3. Напишите варианты реакций получения кислот при взаимодействии оксидов с водой.
SO3 + H2O = H2SO4
SO2 + H2O = H2SO3
CO2 + H2O = H2CO3
CrO3 + H2O = H2CrO4
2Mn2O + 2H2O = 4HMnO4
