
- •Ы физика Авторы: Григорий Николаевич Качалин Елена Владимировна Кошатова Телефон: 7-74-96 г. Саров 2004 г. Ы
- •Механика Механическое движение тела – это изменение его положения в пространстве относительно других тел с течением времени. Основная задача механики: где? когда?
- •1 Закон Ньютона
- •Принцип относительности Галилея
- •Взаимодействие тел
- •Масса тела.
- •Свойства массы
- •Второй закон Ньютона
- •Статика
- •Момент силы - произведение модуля силы на плечо
- •Третий закон Ньютона
- •Виды деформаций растяжение сжатие сдвиг кручение изгиб
- •Закон Гука
- •Силы трения
- •Трение покоя
- •Движение под действием силы тяжести
- •Движение тела под углом к горизонту
- •Графическое изображение работы
- •Давление
- •Условия плавания тел
- •Манометр
- •Эффект Магнуса
- •Размер и масса молекул
- •Определение скоростей молекул
- •Строение жидких твердых и газообразных тел
- •Идеальный газ
- •Основное уравнение мкт идеального газа.
- •Термометры:
- •Изопроцессы в газах
- •Работа в термодинамике
- •Первый закон термодинамики
- •Адиабатный процесс
- •Принцип действия тепловых двигателей
- •Идеальная тепловая машина - Сади Карно 1824 г.
- •Испарение и конденсация.
- •Давление насыщенного пара
- •Критическая температура
- •Влажность воздуха
- •Поверхностное натяжение жидкостей
- •Поверхностная энергия
- •Свойства аморфных тел
- •Электричество и магнетизм
- •Закон сохранения электрического заряда
- •Закон Кулона
- •Электрическое поле
- •Напряжённость электрического поля
- •Электрическое поле точечного заряда
- •Электродвижущая сила
- •Батарейка
- •Закон электролиза (Фарадея)
- •Электрический ток в газах
- •Плазма.
- •Ток в вакууме
- •Электронные пучки и кинескоп
- •Полупроводники
- •Транзистор
- •Магнитное взаимодействие токов
- •Магнитная индукция
- •Правило буравчика
- •Магнитный поток
- •Правило левой руки
- •Магнитные свойства вещества
- •Петля гистерезиса
- •Точка Кюри
- •Электромагнитная индукция
- •Причины электромагнитной индукции.
- •Токи Фуко.
- •Явление самоиндукции.
- •Свободные электромагнитные колебания в контуре
- •Вынужденные электрические колебания
- •Переменный электрический ток.
- •Передача электроэнергии на расстояния.
- •Закон Ома для переменного тока
- •Электрический резонанс.
- •Электромагнитное поле.
- •Свойства электромагнитных волн.
- •Механические колебания.
- •Гармонические колебания.
- •Вынужденные колебания.
- •Механические волны.
- •Принцип Гюйгенса.
- •Отражение волн.
- •Спектры. Спектральный анализ.
- •Спектральный анализ.
- •Шкала электромагнитных волн.
- •Фотоэффект.
- •Законы фотоэффекта.
- •Строение Атома.
- •Опыты Резерфорда по рассеянию - частиц.
- •Постулаты Бора.
- •Энергия и радиусы орбит стационарных состояний.
- •Физика атомного ядра.
- •Закон радиоактивного распада.
- •Изотопы.
- •Методы наблюдения и регистрации частиц.
- •Биологическое действие ионизирующих излучений.
- •Элементарные частицы.
- •Дополнения Вращательное движение твёрдых тел
- •Молекулярно кинетическая теория
- •Законы Кирхгоффа
- •Сферические зеркала
- •Интерференция света в тонком клине
- •Матричная оптика
- •Список литературы
Определение скоростей молекул
Теоретически – Клаузиус (нем.) 19 век, экспериментально – Штерн (нем.) 1920 год
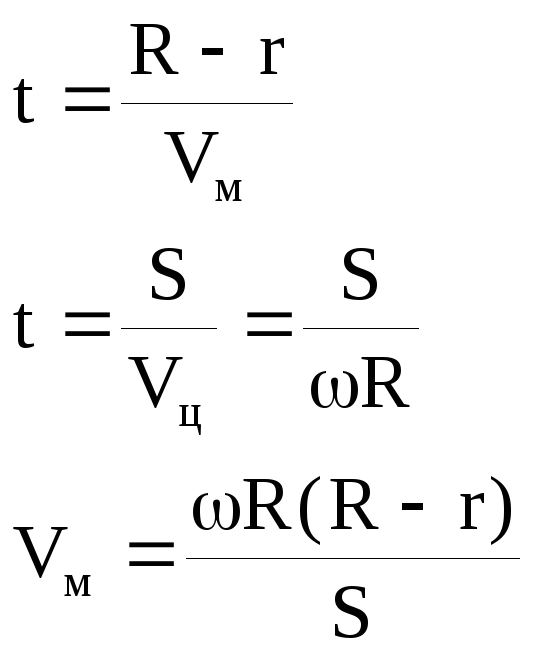
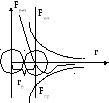
Частицы взаимодействуют друг с другом
Причина электромагнитное взаимодействие электронов и ядер соседних молекул

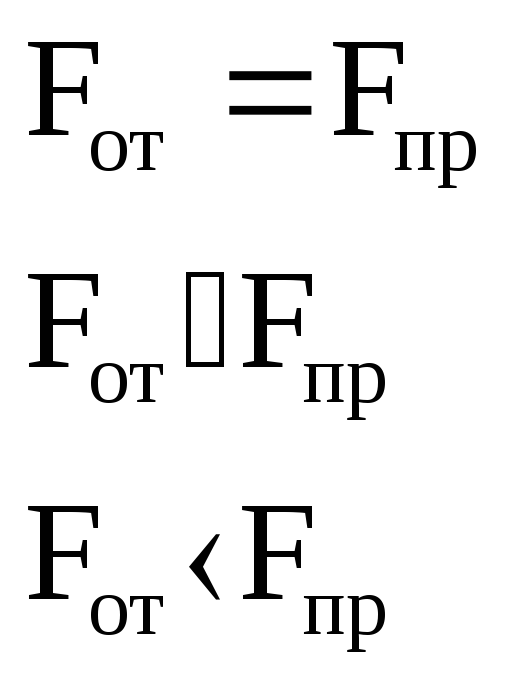
Примеры
-
слипание свинцовых цилиндриков
-
прилипание стекла к воде
-
п
 литки
Иогансана
литки
Иогансана -
сопротивление растяжению и сжатию
-
малая сжимаемость жидких и твердых тел
F
– короткодействующая, но
![]()
Если Fот=Fпр F=0
Если r F0
Если r0 F
Строение жидких твердых и газообразных тел
Газ: не взаимодействует, легко сжимаем, нет формы, заполняет весь объем, “бродяга”.
Жидкость: взаимодействие есть, ближний порядок, малая сжимаемость, форма – сосуда, есть объем “кочевника”.
Т
 вердое
тело: взаимодействие сильное, дальний
порядок (колеб.), мало сжимаемы, есть
форма и объем, “оседлые”.
вердое
тело: взаимодействие сильное, дальний
порядок (колеб.), мало сжимаемы, есть
форма и объем, “оседлые”.
испарение плавление
Газ Жидкость Твердое тело

 конденсация кристаллизация
конденсация кристаллизация

возгонка
 газ твердое тело
газ твердое тело
сублимация
Идеальный газ
Идеальный газ – газ, между молекулами которого отсутствуют силы взаимного притяжения. При соударениях между собой и со стенками сосудов молекулы такого газа ведут себя как абсолютно упругие шарики весьма малых размеров. Эти соударения происходят по законам абсолютно упругого тела.
идеальный
газ
молекулы
– маленькие твердые шарики столкновения
абсолютно упругие Fпр
0 Fот
при столкновении

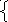 v1=v2
– равенство Е
v1=v2
– равенство Е
= - равенство Р
Основное уравнение мкт идеального газа.
![]()
- Основное уравнение МКТ идеального газа.
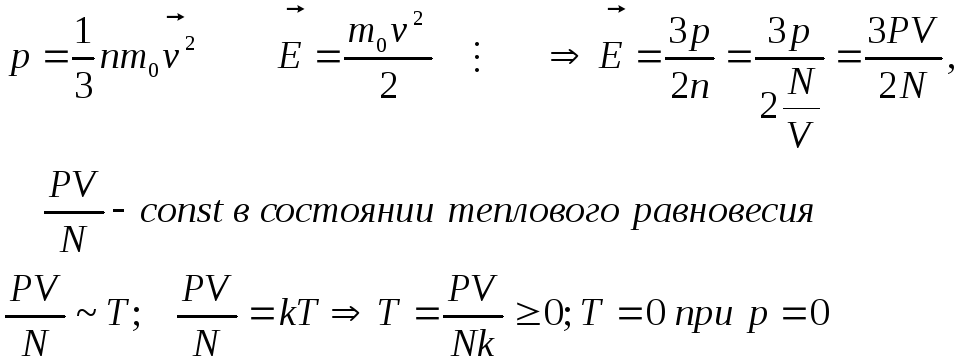
Тепловое равновесие – прекращение изменения макроскопических параметров после установления контакта между телами.
Температура – физический параметр, одинаковый во всех частях системы тел, находящихся в состоянии теплового равновесия. Т0,К, t0C Т= t0C+273, Т=0 при t=-273,15 –абсолютный нуль
T=t
Абсолютная шкала температур -273,15 0 100 t0C

0 273,..15 373,15 Т0,К
Термометры:
В основе термометров лежит свойство жидкостей расширяться при нагревании – ртуть, спирт, глицерин.
П ринцип
действия
ринцип
действия
Термометры приводят в контакт с телами,
идет теплопередача до установления теплового равновесия.
Vж=0 при прекращении теплообмена.
Газовый термометр.
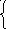
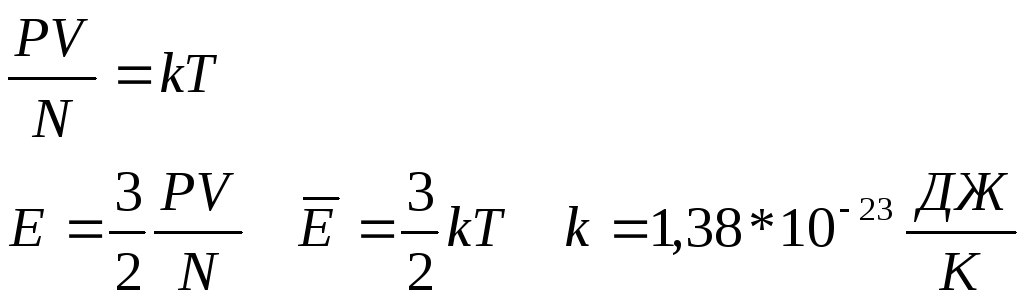
к – постоянная Больцмана
Температура – мера кинетической энергии молекул, но Т=0 не достижима
![]() - быстрее снаряда.
Опытная проверка Штерн.
- быстрее снаряда.
Опытная проверка Штерн.
Уравнение состояния идеального газа
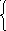
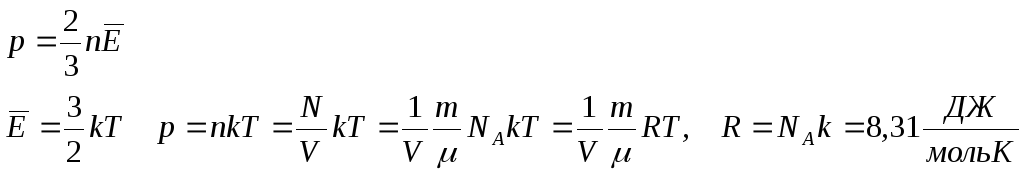
![]() - Уравнение
Менделеева – Клайперона
- Уравнение
Менделеева – Клайперона
Е сли
m,=const,
то
сли
m,=const,
то
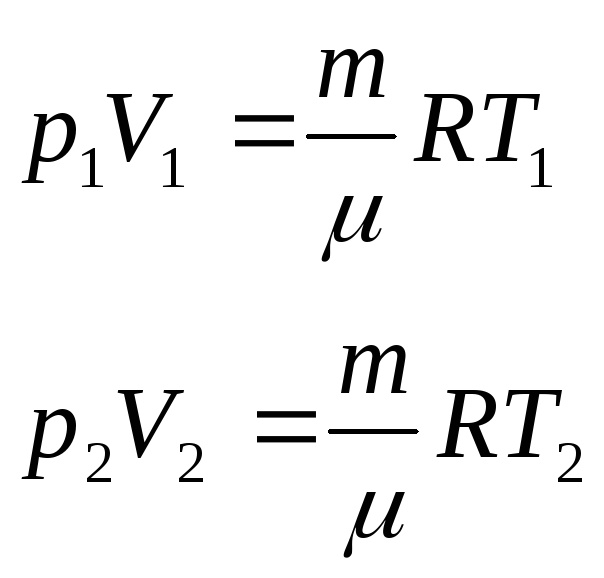
![]()
Изопроцессы в газах
Изопроцесс – термодинамический процесс, протекающий в системе с неизменной массой при постоянном значении одного из параметров состояния системы.
Изотермический процесс
Закон Бойля – Мариотта
T ,
m,
,
m,
![]() – const медленно
– const медленно
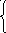
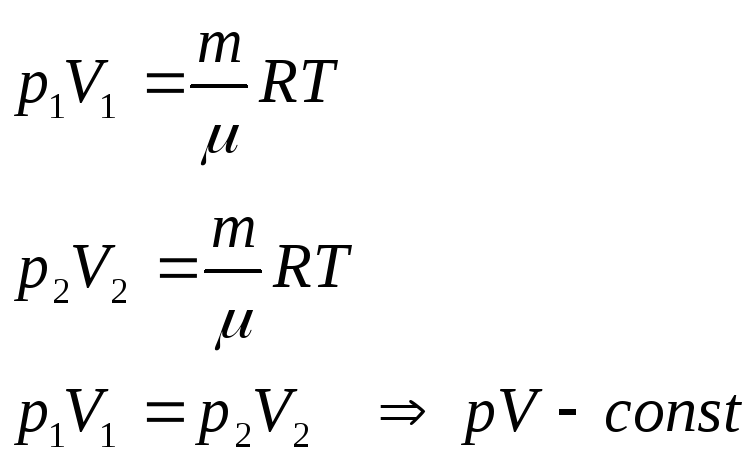
![]()
Произведение давления данной массы газа на его объем постоянно, если температура газа не меняется
 Изотермы
Изотермы


Изобарный процесс
Закон Гей - Люссака
T,
m,
![]() –
const
–
const

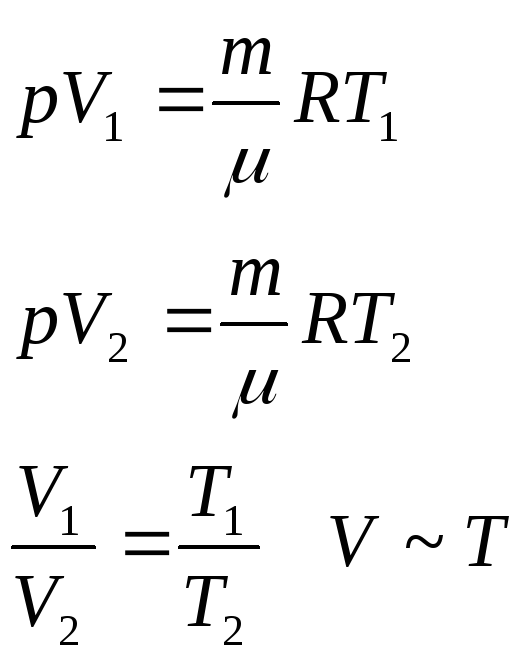
Объем данной массы газа при постоянном давлении пропорционален температуре.
Изобары



V=V0(1+t), где =1/273 – термический коэффициент объемного расширения.
Изохорный процесс
Закон Шарля
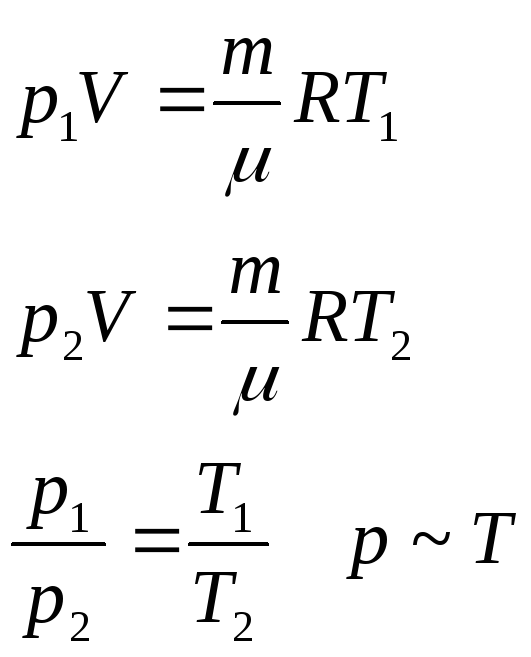
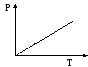
Давление данной массы газа при постоянном объеме пропорционально температуре.
И

 зохоры
зохоры
![]() ,
где - термический
коэффициент давления
,
где - термический
коэффициент давления
Внутренняя энергия
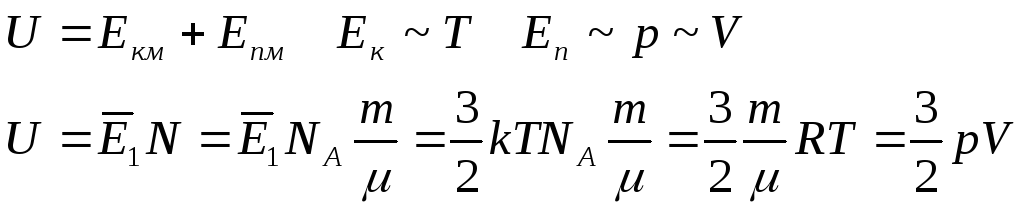
![]() -
одноатомный газ,
-
одноатомный газ,
![]() -
двухатомный газ,
-
двухатомный газ,
![]() -
двухатомный газ.
-
двухатомный газ.
Внутренняя энергия определяется термодинамическим состоянием системы и не зависит от того , каким образом система оказалась в данном состоянии.
Практический интерес представляет не сама внутренняя энергия, а не изменение U.
Способы изменения внутренней энергии


 работа теплопередача
работа теплопередача

теплопроводность конвекция излучение
Энергия, переданная телу в результате теплообмена, называется количеством теплоты
Q1=Q2 – уравнение теплового баланса.
Q=cmT – нагревание, охлаждение
Q=qm – при сгорании топлива
Q=m – плавление, кристаллизация
Q=Lm - парообразование, конденсация
Q>0 при поглощении
Q<0 при выделении тепла
Коэффициент
полезного действия:![]() .
.
Удельная теплоемкость – теплоемкость единицы массы однородного вещества
![]() ,
,
1 кал = 4.19 Дж
