
- •Вопросы к экзамену первой части курса «Общая и неорганическая химия»
- •Примеры экзаменационных билетов Экзаменационный билет № 1
- •1. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов в энергетических ячейках (атомных орбиталях), в электронных оболочках и слоях. Правило Хунда.
- •1. Последовательность заполнения электронных оболочек и слоев в атомах. Принцип наименьшей энергии, правило Клечковского. Способы изображения электронных структур атомов.
- •1. Периоды, группы, подгруппы и семейства s-, p-, d- и f-элементов с точки зрения электронного строения атомов. Объяснение различной длины периодов. Длинно- и короткопериодный варианты системы.
- •1. Периодические свойства атомов. Радиусы (размеры) атомов и ионов и их изменение по периодам и группам периодической системы. D- и f-сжатие.
- •2. Типы окислительно-восстановительных реакций (межмолекулярного окисления-восстановления, диспропорционирования, внутримолекулярного окисления-восстановления). Привести примеры.
- •Ответ на экзаменационный билет № 1
- •Вопрос 1.
- •Вопрос 2.
- •Вопрос 3.
Вопрос 2.
Гидролиз солей – это взаимодействие соли с водой, приводящее к образованию сильного и слабого электролита. Рассмотрим типичные случаи гидролиза. Гидролизу подвергаются соли, образованные:
а) сильной кислотой и слабым основанием, такие соли гидролизуются по катиону. Рассмотрим гидролиз хлорида алюминия AlCl3. Сначала запишем диссоциацию этой соли:
AlCl3 Al3+ + 3Cl-
Видно, что в образовании этой соли принимали участие слабое основание Al(OH)3 и сильная кислота HCl. В реакции гидролиза принимает участие частица, входящая в состав слабого основания:
Al3+ + H-O-H Al(OH)2+ + H+
Катион алюминия, частица слабого основания, отнимает от воды гидроксильную группу ОН-. В результате образуются катионы Al(OH)2+ и катионы водорода H+, обуславливающие кислую среду раствора соли AlCl3. Приведенное уравнение взаимодействия катиона алюминия с водой называется ионным уравнением, запишем молекулярное уравнение:
AlCl3 + H2O Al(OH)Cl2 + HCl
Итак, в результате гидролиза хлорида алюминия в растворе образовалась сильная кислота - соляная (сильный электролит) и основная соль – гидроксохлорид алюминия (слабый электролит). Так как в растворе образуется сильная кислота, то среда раствора будет кислая, рН будет меньше 7;
б) слабой кислотой и сильным основанием. Такие соли гидролизуются по аниону. Рассмотрим гидролиз карбоната натрия Na2CO3. Сначала запишем диссоциацию этой соли:
Na2CO3 2Na+ + CO32-
Видно, что в образовании этой соли принимали участие сильное основание NaOH и слабая кислота H2CO3. В реакции гидролиза принимает участие частица, входящая в состав слабой кислоты:
CO32- + H-O-H HCO3- + OH-
Карбонат-анион, частица слабой кислоты, отнимает от воды ион водорода H+. В результате образуются анионы HCO3- и анионы гидроксила OH-, обуславливающие основную (щелочную) среду раствора соли Na2CO3. Приведенное уравнение взаимодействия катиона алюминия с водой называется ионным уравнением, запишем молекулярное уравнение:
Na2CO3 + H2O NaHCO3 + NaOH
Итак, в результате гидролиза карбоната натрия в растворе образовалось сильное основание – гидроксид натрия (сильный электролит) и кислая соль – гидрокарбонат натрия (слабый электролит). Так как в растворе образуется сильное основание, то среда раствора будет основная (щелочная), рН будет больше 7.
Соль, образованная сильным основанием и сильной кислотой гидролизу не подвергается. Соли, образованные слабой кислотой и слабым основанием, подвергаются одновременно гидролизу по катиону и аниону или же разлагаются водой, если гиролиз протекает необратимо (с выделением газа или осадка), например, в случае сульфида алюминия Al2S3:
Al2S3 + 3H2O Al(OH)3 + H2S
Степень гидролиза – это отношение молярной концентрации гидролизованных молекул соли к общей молярной концентрации соли в растворе:
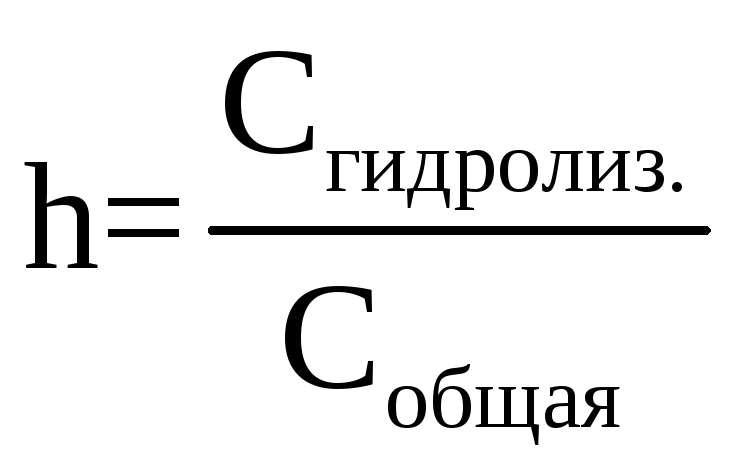
Однако использовать эту формулу для расчета степени гидролиза эту формулу, как правило, неудобно, потому применяют формулу, аналогичную закона разбавления Оствальда:
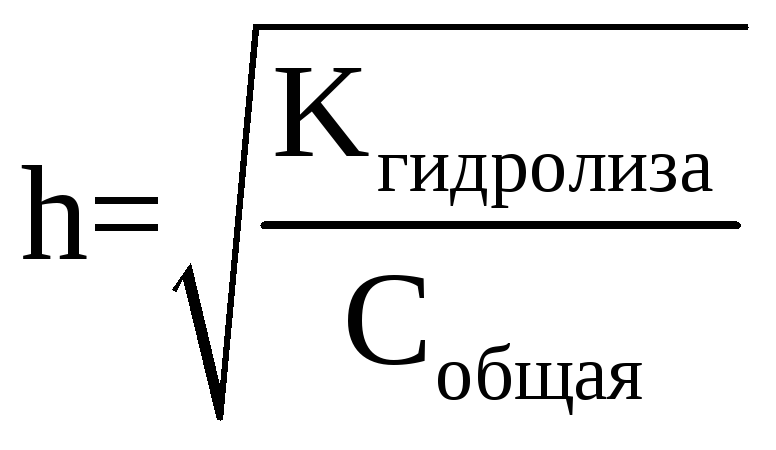
где Кгидролиза – это константа гидролиза соли, зависящая от природы соли (т.е. каким именно слабым основанием или какой именно слабой кислотой она образована), ее вычисляют как:
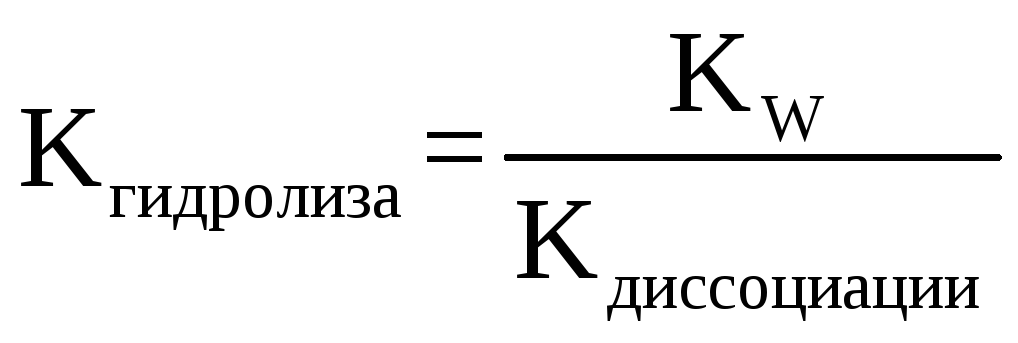
где Kw – ионное произведение воды, равное 10-14 при 25С, Kдиссоциации – константа диссоциации соответствующей слабой кислоты или слабого основания. Именно в константе гидролиза выражена зависимость степени гидролиза от природы соли, поскольку значение Kдиссоциации – индивидуальная величина, свойственная лишь данному слабому электролиту (кислоте или основанию). Зависимость степени гидролиза от концентрации, как видно из формулы расчета, обратная – чем выше концентрация, тем меньше степень гидролиза.
Зависимость степени гидролиза от температуры прямая – чем выше температура, тем выше степень гидролиза. Это связано с тем, что процесс разложения воды под действием частицы слабого электролита на катион водорода и анион гидроксогруппы – процесс эндотермический, т.е. с ростом температуры равновесие в таком процессе смещается вправо, в сторону образования гидролизованных частиц. Таким образом, повторим, увеличение температуры приводит к увеличению степени гидролиза.
