
- •§31. Елементи геометричної оптики
- •§32. Теплове випромінювання тіл
- •§ 33. Фотоефект
- •§34. Фотони. Енергія, маса та імпульс фотона. Тиск світла. Ефект Комптона.
- •§ 35. Основи квантової фізики. Гіпотеза де Бройля. Хвильова функція. Рівняння Шрьодінгера
- •§36. Рух мікрочастинки в нескінченно глибокій одновимірній потенціальній ямі. Проходження частинки через потенціальний бар’єр
- •§ 37. Ядерна модель атома. Борівський водне подібний атом. Спектральні серії
- •§38. Водне подібні атоми в квантовій фізиці
- •§39. Магнітний момент атомів. Досліди Штерна і Герлаха. Спін. Ферміони і бозони. Принцип Паулі. Багатоелектронні атоми
- •§40. Будова і властивості атомного ядра. Ядерні сили
- •§8.3. Радіоактивність. Ядерні реакції
§38. Водне подібні атоми в квантовій фізиці
Розглянемо фізичну систему, яка складається з негативно зарядженого електрона, який перебуває в електричному полі позитивно зарядженого ядра. Таку систему будемо називати водне подібним атомом. Стаціонарне рівняння Шредінгера для водне подібного атома має вигляд
![]() . (1)
. (1)
О
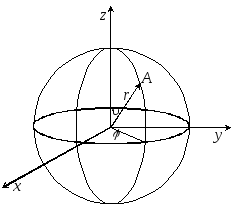 Рис.
1
Рис.
1![]() .
В цьому випадку рівняння Шредінгера
набуває складнішого вигляду, але
з’являється можливість представити
хвильову функцію як добуток радіальної
функції R(r)
і кутової
.
В цьому випадку рівняння Шредінгера
набуває складнішого вигляду, але
з’являється можливість представити
хвильову функцію як добуток радіальної
функції R(r)
і кутової
![]() ,
тобто провести розділення змінних:
,
тобто провести розділення змінних:
![]() . (2)
. (2)
Стандартні
вимоги як до хвильової функції в цілому,
так і до окремих складових забезпечуються
лише при певних, дискретних значеннях
не тільки енергії електрона, але і
квадрату моменту імпульсу його
орбітального руху
![]() ,
а також проекції цього моменту
,
а також проекції цього моменту
![]() на
вибраний напрямок (вісь z).
Квантування вказаних характеристик
визначається трьома квантовими числами:
головним n,
орбітальним (азимутальним)
на
вибраний напрямок (вісь z).
Квантування вказаних характеристик
визначається трьома квантовими числами:
головним n,
орбітальним (азимутальним)
![]() та магнітним
та магнітним
![]() наступним чином:
наступним чином:
![]() ,
де n=1,2,3,…,
(3)
,
де n=1,2,3,…,
(3)
![]() , де
, де
![]() =
0,1,2,…, (n-1); (4)
=
0,1,2,…, (n-1); (4)
![]() , де
, де
![]() . (5)
. (5)
М
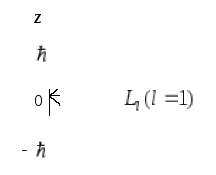 Рис.2
Рис.2![]() (рис. 2).
(рис. 2).
Оскільки
енергія електрона Еn
визначається
лише головним квантовим числом n,
а хвильова функція
![]() – усіма квантовими числами, то декільком
станам з різними
– усіма квантовими числами, то декільком
станам з різними
![]() та
та
![]() відповідає
одне значення енергії. Така ситуація
називається квантовомеханічним
виродженням.
Наприклад, енергія Е2
реалізується в чотирьох станах з
хвильовими функціями
відповідає
одне значення енергії. Така ситуація
називається квантовомеханічним
виродженням.
Наприклад, енергія Е2
реалізується в чотирьох станах з
хвильовими функціями
![]()
![]()
![]()
![]() .
В загальному, кратність виродження
дорівнює n2.
.
В загальному, кратність виродження
дорівнює n2.
Для основного стану (n = 1) хвильова функція має вигляд
![]()
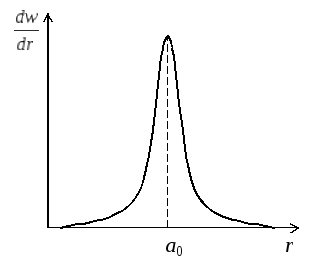 Рис.4
Рис.4
Імовірність
знайти електрон в сферичному шарі
товщиною dr,
тобто в елементарному об’ємі
![]() ,
становить
,
становить
![]() (7)
(7)
а в шарі одиничної товщини –
![]() . (8)
. (8)
Як
видно з рис. 4, залежність
![]() володіє різким максимумом при r = а0.
Отже, борівська орбіта в квантовій
механіці може інтерпретуватись як
геометричне місце точок, де імовірність
перебування електрона – максимальна.
Але, оскільки заряд електрона “розмазаний”
по усьому атомі
володіє різким максимумом при r = а0.
Отже, борівська орбіта в квантовій
механіці може інтерпретуватись як
геометричне місце точок, де імовірність
перебування електрона – максимальна.
Але, оскільки заряд електрона “розмазаний”
по усьому атомі
![]() ,
то в квантовій механіці, у відповідності
зі співвідношенням невизначеностей
Гейзенберга, поняття орбіти (траєкторії)
електрона втрачає зміст.
,
то в квантовій механіці, у відповідності
зі співвідношенням невизначеностей
Гейзенберга, поняття орбіти (траєкторії)
електрона втрачає зміст.
С
Рис.
3
![]() прийнято позначати наступним чином:
прийнято позначати наступним чином:
|
|
0 |
1 |
2 |
3 |
4 |
. |
|
Стан |
s |
p |
d |
f |
g |
І тому енергетичні рівні з різними n реалізуються наступними станами:
|
n = 1 – |
стан |
1s; |
|
|
|
|
n = 2 – |
стани |
2s, |
2p; |
|
|
|
n = 3 – |
стани |
3s, |
3p, |
3d; |
|
|
n = 4 – |
стани |
4s, |
4p, |
4d, |
4f. |
Стан
1 s
є основним, усі інші стани – збуджені.
Час життя електрона в збудженому стані
складає ~![]() .
.
Енергетична
діаграма квантовомеханічного атома
водню має вигляд (рис. 3), який дещо
відрізняється від діаграми борівського
атома. Як і раніше, квантова механіка
не накладає жодного обмеження на зміну
головного квантового числа. В цей же
час зміна
![]() і
і
![]() регламентується правилами відбору
регламентується правилами відбору
![]() . (9)
. (9)
Друге правило відбору тут не проявляється, але стає важливим, коли випромінюючі атоми перебувають в магнітному полі.
