
- •1. Простейшие стехиометрические расчеты
- •Задания для выполнения контрольной работы
- •2. Строение атома.
- •3. Химическая связь. Примеры решения типовых задач
- •4. Основные понятия о химической кинетике. Примеры решения типовых задач
- •5. Растворы электролитов
- •6. Основы электрохимии. Примеры решения типовых задач
- •7. Классификация неорганических веществ. Примеры решения типовых задач
- •Варианты контрольных заданий
- •Список литературы
6. Основы электрохимии. Примеры решения типовых задач
Пример 1. Для данного окислительно – восстановительного процесса: а)составьте реакции окисления и восстановления; б)укажите окислитель и восстановитель; в)составьте сокращенное ионное и полное молекулярное уравнения ионно – электронным методом; г)покажите переход электронов.
Дана схема окислительно-восстановительного процесса
K2MnO4
+
K2SO4
+ H2O
KMnO4
+ K2SO3
+
KOH
Решение.
По приведенной схеме делаем вывод, что процесс протекает в щелочной среде (присутствует КОН, рН>7). Находим степени окисления всех элементов данной схемы:

Составляем возможные уравнения реакций окисления и восстановления, находим значения их стандартных электродных потенциалов:
|
1 |
|
окис-ление |
восста- новитель |
|
|
2 |
|
восста- новле-ние |
окисли- тель |
|
Составляем сокращенное ионное уравнение процесса и показываем переход электоронов:
S+4O32-
+
2Mn+7O4-
+2OH-
=
S+6O42-
+ 2Mn+6O42-
+ H2O.

2 е
Переходим к полному молекулярному уравнению, показываем переход электронов:
2KMn+7O4
+ K2S+4O3
+ 2KOH = 2K2Mn+6O4
+ K2S+6O4
+ H2O

2e
Пример
2.
Составьте схему работы гальванического
элемента, образованного двумя данными
металлами, погруженными в растворы
солей с известными активностями ионов,
рассчитайте ЭДС этого элемента и
 .
.
Дано: Zn; Pb; растворы ZnSO4 и Pb(NO3)2;
Решение
Равновесие
для первого электрода Zn
ZnSO4
(0,01M).
Токообразующая реакция ZnO = Zn2+ + 2e.

Аналогично, для второго электрода Pb Pb(NO3)2 (0,001 M).
Токообразующая
реакция Pb
= Pb2+
+ 2е.

При
составлении гальванического элемента
более отрицательным электродом будет
система Zn
Zn2+,
более положительным – Pb
Pb2+.
Схема гальванического элемента примет
следующий вид
(-)Zn ZnSO4(0,01 M) Pb(NO3)2 (0,001 M) Pb(+).
При наличии внешней цепи на электродах протекают следующие реакции
|
1 |
Zn0 = Zn+2 + 2e |
окисление |
восстановитель |
Анод |
|
2 |
Pb2+ + 2e = Pb0 |
восстановление |
окислитель |
Катод |
Реакция
в элементе в целом Zn0
+ Pb2+
= Zn2+
+ Pb0.
2e
Электродвижущая сила этого элемента может быть рассчитана как по ранее определенным электродным потенциалам, так и непосредственно.
1
вариант E298
=
 катода
–
катода
–
 анода
=
анода
=
 -
-
 =
-0,2145 – (-0,822) = 0,6075 В.
=
-0,2145 – (-0,822) = 0,6075 В.
2
вариант E298
=
 –
–
 =
=
 +
+
 -
-
 -
-
 = (
= ( –
–
 )
+
)
+
 ))
+
))
+

Если бы в условии были заданы металлы в разных степенях окисления, то следовательно бы использовать величины количеств электронов z1,z2.
Пример 3. При электролизе раствора данной соли металла током I, A, масса катода возросла на m грамм. Учитывая, что выход по току металла Bi, %, рассчитайте, какое количество электричества и в течение какого времени пропущено. Составьте схему электролиза.
Дано: CoSO4; I = 1,25 A; m = 1,0883 г; Bi = 72%.
Решение
Составляем схему электролиза с нерастворимым анодом. Электрохимическая система имеет следующий вид
(-) Fe CoSO4, H2O Ti (+).
В качестве покрываемого металла выбрано железо; нерастворимого анода– титан.
В растворе присутствуют следующие ионы и молекулы
СoSO4
Co2+
+
 (электролитическая
диссоциация);
(электролитическая
диссоциация);
Сo2+
+ 2H2O
= Co(OH)2
+ H2SO4
(гидролиз);
Сo2+ +2H2O = Co(OH)2 + 2H+, pH < 7, среда кислая.
Следовательно,
при составлении схемы электролиза надо
учитывать ионы Сo2+,
 ,
H+,
молекулы СoSO4,
H2O,
Co(OH)2.
,
H+,
молекулы СoSO4,
H2O,
Co(OH)2.
Реакции на электродах
А: 2H2O = O2 + 4H+ + 4e;
К: Co2+ + 2e = Co0; 2H+ + 2e = H2.
Из – за выделения водорода на катоде совместно с восстановлением ионов Со (II) выход по току металла меньше 100%.
Схема электролиза водного раствора СoSO4 с нерастворимым анодом:
СoSO4
Катод Анод
Со2+



Н+
Н2О



4Н+
Co2+ + 2e = Co,
2H+ + 2e = H2. 2H2O = O2 + + 4е.
Далее составляем схему электролиза с растворимым анодом. Электрохимическая система:
(-) Fe CoSO4, H2O Co (+).
Реакции на электродах:
А: 2Co0 = 2Co2+ + 4e.
K: Сo2+ + 2e = Co0,
2H+ + 2e = H2.
Схема электролиза водного раствора CoSO4 с растворимым анодом:
CoSO4
Катод Анод
Со2+



Н+


Со2+
Co2+ + 2e = Co,
2H+ + 2e = H2. 2Со0 = 2 + 4е.
Количество электричества по закону Фарадея составит

Оно пропущено в течение времени t:

Задачи для выполнения контрольной работы
Для данного окислительно-восстановительного процесса (см. табл. 6.1.)
а) составьте реакции окисления и восстановления; б)укажите окислитель и восстановитель; в)составьте сокращенное ионное и полное молекулярное уравнения ионно-электронным методом; г)покажите переход электронов
Таблица 6.1
|
Вариант |
Реакции |
|
281 |
H2O2
+
KMnO4+
H2SO4
MnSO4
+
K2SO4
+ O2
+ H2O |
|
282 |
NaNO2
+
NaI + H2SO4
NO + I2
+ Na2SO4
+ H2O |
|
283 |
NaI
+ H2SO4
+ MnO2
NaHSO4
+ H2O
+ I2
+
MnSO4 |
|
284 |
MnSO4
+ S + K2SO4
+ H2O
KMnO4
+
H2S
+ H2SO4 |
|
285 |
K2SO4
+ Cr2(SO4)3
+ Fe2(SO4)3
+ H2O
K2Cr2O7
+
H2SO4
+
FeSO4 |
|
286 |
KCl
+ Fe2(SO4)3
+ H2O
KClO3
+ FeSO4
+ H2SO4 |
|
287 |
FeCl3
+ MnCl2
+ KCl + H2O
FeCl2
+ KMnO4
+ HCl |
|
288 |
K2SO4
+ Cr2(SO4)3
+ H2O
K2Cr2O7
+ H2SO4
+
SO2 |
|
289 |
K2Cr2O7
+ H2S+
H2SO4
Cr2(SO4)3
+
S + K2SO4
+ H2O |
|
290 |
K2SO4
+ I2
+
NO2
+
H2O
KI + HNO3
+
H2SO4 |
|
291 |
Fe2(SO4)3
+
NO + H2O
FeSO4
+ HNO3
+
H2SO4 |
|
292 |
MnSO4
+ Br2
+ Na2SO4
+
K2SO4
+ H2O
KMnO4
+ NaBr + H2SO4 |
|
293 |
HMnO4
+ Pb(NO3)2
+ H2O
PbO2
+
Mn(NO3)2
+ HNO3 |
|
294 |
KCl
+ NaCl + H2O+
CO2
KClO3
+ Na2C2O4
+ HCl |
|
295 |
Na2C2O4
+KMnO4
+H2SO4
MnSO4
+K2SO4
+Na2SO3
+ H2O
+CO2 |
|
296 |
K2MnO4
+ O2
+H2O
KMnO4
+ H2O2
+ KOH |
|
297 |
MnCl2
+ Cl2
+ KCl + H2O
KMnO4
+ HCl |
|
298 |
HNO2
+ KMnO4
+ H2SO4
HNO3
+ MnSO4
+
K2SO4
+
H2O |
|
299 |
PbSO4
+ ZnSO4
+ H2O
PbO2
+ H2SO4
+ Zn |
|
300 |
Al2(SO4)3
+ Cr2(SO4)3
K2SO4
+ H2O
Al + K2Cr2O7
+ H2SO4 |
|
301 |
K2CrO4
+ KBr + H2O
+
KCl CrCl3
+ Br + KOH |
|
302 |
Na2SO4
+ I2
+
K2SO4
+ H2O
Na2SO3
+
KIO3
+
H2SO4 |
|
303 |
Na2SO4
+ Ag + NaNO3
+ H2O
Na2SO3
+ AgNO3
+ NaOH |
|
304 |
KI
+
KNO2
+ H2SO4
I2
+ NO + K2SO4
+
H2O
|
|
305 |
CO2
+ MnSO4
+ H2O
H2C2O4
+ MnO2
+
H2SO4 |
|
306 |
H2O2
+ PbO2
+
CH3COOH
O2
+ Pb(CH3COO)2
+H2O |
|
307 |
Ti(SO4)2
+ MnSO4
+ K2SO4
+ H2O
Ti2(SO4)3
+ KMnO4
+ H2SO4 |
|
308 |
KBr
+ MnO2
+
KCl + H2O
KBrO + MnCl2
+
KOH |
|
309 |
MnSO4
+ NaHSO4
+ H2O
+ Cl2
MnO2
+ NaCl + H2SO4 |
|
310 |
K2Cr2O7
+
KI + H2SO4
Cr2(SO4)3
+
I2
+ K2SO4
+ H2O |
6.2 Расчет электродвижущей силы гальванического элемента в стандартных условиях по известной реакции в элементе.
Дана
реакция, протекающая в гальваническом
элементе. Рассчитайте
 ,
составьте схему элемента, реакции на
электродах.
,
составьте схему элемента, реакции на
электродах.
Таблица 6.2
|
Вариант |
Реакции |
|
311 |
PbO2 (к) + 2H2SO4(ж) + Zn(к) = PbSO4(к) + ZnSO4(к) + 2H2O(ж) |
|
312 |
PbO2 (к) + 2H2SO4(ж) + Сb(к) = PbSO4(к) + CbSO4(к) + 2H2O(ж) |
|
313 |
Cu2Cl2 (к) + Mg(к) = 2Cu (к) + MgCl2 (к) |
|
314 |
2Ag (к) + MgCl2 (к) = 2AgCl (к) +Mg(к) |
|
315 |
PbO2 (к) + 2H2SO4 (ж) + Pb (к) = 2PbSO4 (к) + 2H2O (ж) |
|
316 |
2Pb (к) + O2 (г) + 2H2O (ж) = 2Pb(OH)2 (к) |
|
317 |
O2 (г) + 2Sn (к) + 2H2O (ж) = 2Sn(OH)2 (к) |
|
318 |
O2 (г) + 2Мn (к) + 2H2O (ж) = 2Мn(OH)2 (к) |
|
319 |
Ag2O (к) + Cd (к) = 2Ag (к) + CdO (т) |
|
320 |
O2(г) + 2Fe (т) + 2H2O (ж) = 2Fe(OH)2 (к) |
|
321 |
HgO (красн.к) + Zn (к) = ZnO (к) + Hg (к) |
|
322 |
2CuCl (к) + Mg (к) = MgCl2 (к) + 2Cu (к) |
|
323 |
Th (к) + O2 (г) + 2H2O (ж) = Th(OH)4 (к) |
|
324 |
2Ga (к) +3/2 O2 (г) + 3H2O (ж) = 2Ga(OH)3 (к) |
|
325 |
O2 (г) + 2Mg (к) + 2H2O (ж) = 2Mg(OH)2 (т) |
|
326 |
O2 (г) + 2Ni (к) + 2H2O (ж) = 2Ni(OH)2 (т) |
|
327 |
3/2 O2 (г) + 2Fe (к) + 3H2O (ж) = 2Fe(OH)3 (к) |
|
328 |
Ag2O (к) + Zn (к) = 2Ag (к) + ZnO (к) |
|
329 |
CuCl2 (к) = CuCl (к) + 1/2Cl2 (г) |
|
330 |
Сl2 (г) + Zn (к) = ZnCl2 (к) |
|
331 |
2H2O (ж) + 2Li (к) = 2LiOH (к) + H2(г) |
|
332 |
O2 (г) + 4Li (т) + 2CO2 (г) = 2Li2CO2 (т) |
|
333 |
Mg (к) + 2H2O (ж) = Mg(OH)2 (к) + H2(г) |
|
334 |
O2 (г) + 2Zn (к) = 2ZnO (к) |
|
335 |
3/2 O2 (г) + 2Au (к) + 3H2O (ж) = 2Au(OH)3 (к) |
|
336 |
2Cd (к) + O2 (г) + 2H2O (ж) = 2Cd(OH)2 (к) |
|
337 |
5Zn(к) + 2KIO3(к) + 6H2SO4(ж) = 5ZnSO4 (к) + I2 (к) + K2SO4(к)+6H2O(ж) |
|
338 |
PbSO4(к) + H2O (ж) = Pb ()+ ½ O2(г) + H2SO4(ж) |
6.3
Составьте схему гальванического
элемента, образованного двумя данными
металлами, погруженными в растворы
солей с известной активностью ионов;
рассчитайте ЭДС этого элемента и
 .
.
Таблица 6.3
|
Вариант |
Металлы |
Соли |
Активности |
|
339 |
Cr, Al |
CrCl3, AlI3 |
|
|
340 |
Mn, Co |
MnCl2, CoCl2 |
|
|
341 |
Fe, Cd |
FeCl2, CdBr2 |
|
|
342 |
Cu, Ag |
CuSO4, AgNO3 |
|
|
343 |
Sn, Al |
SnBr2, AlCl3 |
|
|
344 |
Au, Fe |
AuCl3, FeCl2 |
|
|
345 |
Cd, In |
CdBr2, In(NO3)3 |
|
|
346 |
Sb, Co |
SbF3, CoCl2 |
|
|
347 |
Cd, Ni |
CdCl2, NiSO4 |
|
|
348 |
Re, Co |
ReCl3, Co(NO3)3 |
|
|
349 |
Pd, Cd |
PdSO4, CdI2 |
|
|
350 |
Sb, Co |
SbCl3, CoSO4 |
|
|
351 |
Cr, Sn |
CrBr3, SnCl4 |
|
|
352 |
Nd, Mn |
NdCl3, MnSO4 |
|
|
353 |
Sn, Cd |
SnBr2, CdSO4 |
|
|
354 |
Ti, Cr |
TiCl3, CrCl2 |
|
|
355 |
Mn, In |
MnSO4, InBr3 |
|
|
356 |
Pb, Cr |
PbCl2, CrCl3 |
|
|
357 |
Ni, Nd |
Ni(NO3)2, NdCl3 |
|
|
358 |
Re, Cr |
ReCl3, Cr(NO3)3 |
|
|
359 |
Cu, Cd |
CuCl2, CdBr2 |
|
|
360 |
In, Cr |
In(NO3)3, Cr(SO4)2 |
|
|
361 |
Mn, Cu |
MnCl2, Cu(NO3)2 |
|
|
362 |
Ni, Cu |
NiSO4, CuBr2 |
|
|
363 |
Ti, Fe |
TiCl3, FeBr2 |
|
|
364 |
Cr, Fe |
CrCl3, FeCl3 |
|
|
365 |
Mn, In |
Mn(NO3)2, InCl3 |
|
|
366 |
Pb, Fe |
PbCl2, Fe(NO3)3 |
|
|
367 |
Ni, In |
NiCl2, InBr3 |
|
|
368 |
Re, Fe |
ReCl3, Fe(SO4)3 |
|



 +e
=
+e
=

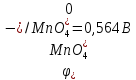






























 M;
M;

 M;
M;
 M
M M;
M;
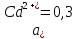 M
M M;
M;
 M
M M;
M;
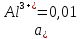 M
M M;
M;
 M
M M;
M;
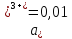 M
M 2M;
2M;
 M
M M;
M;
 M
M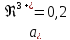 M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
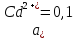 M
M M;
M;
 M
M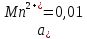 M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
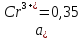 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M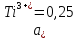 M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M M;
M;
 M
M