
- •1. Простейшие стехиометрические расчеты
- •Задания для выполнения контрольной работы
- •2. Строение атома.
- •3. Химическая связь. Примеры решения типовых задач
- •4. Основные понятия о химической кинетике. Примеры решения типовых задач
- •5. Растворы электролитов
- •6. Основы электрохимии. Примеры решения типовых задач
- •7. Классификация неорганических веществ. Примеры решения типовых задач
- •Варианты контрольных заданий
- •Список литературы
5. Растворы электролитов
Примеры решения типовых задач
Пример 1. Найдите массу AlCl3, необходимую для приготовления 2 л (2*10-3 м3) раствора с массовой долей хлорида алюминия равной 12%. Плотность раствора 1090 кг/м3. Вычислите молярну концентрацию эквивалента, молярную концентрацию, молярность и титр раствора.
Решение.
1.Определяем молярную массу и молярную массу эквивалента AlCl3
М(
AlCl3)
= 133,34 г/моль, Э(AlCl3)
=

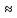 44,45 г/моль.
44,45 г/моль.
2.Находим
массу AlCl3,
необходимую для приготовления 2 л его
раствора с массовой долей 12 %. Массовая
доля
 показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора.
показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора.
Масса
раствора равна произведению объема
раствора (V)
на его плотность ( ).
).
М = 2*10-3*1090 кг/м3 = 2,18 кг.
В 100 кг раствора содержится 12 кг AlCl3
В 2,18 кг раствора содержится х кг AlCl3

3.Находим молярную концентрацию раствора. Молярная концентрация раствора СМ показывает количество растворенного вещества, содержащего в 1 л раствора.
В 2 л раствора содержится 261,6 г AlCl3.
В 1 л раствора содержится х г AlCl3,

Молярная
концентрация равна

4.Находим молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальная концентрация) раствора показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора.

5.Нахолим молярность раствора. Молярность раствора Сm (моль/кг) показывает количество растворенного вещества, находящееся в 1 кг растворителя.
Масса воды равна 2180 г – 261,6 г = 1918,4 г.
Количество
AlCl3
равно

В 1918,4 г H2O растворено 1,96 моль AlCl3.
В 1000 г H2O растворено х моль AlCl3,

6.Находим титр раствора. Титр раствора Т показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л раствора содержится 130,8 г AlCl3.
 .
.
Пример 2. Напишите уравнение электролитической диссоциации муравьиной кислоты и найдите концентрации ионов Н+ и НСОО- в моль /л в растворе, молярность которого равна 0,01, если константа диссоциации
К дисс = 1,8*10-4
Решение.
HCOOH
H+
+
HCOO-
Cион = C* α *n, где С – молярная концентрация электролита; α – степень диссоциации; n – число ионов данного вида.
Степень диссоциации приближенно находим из выражения упрощенного закона Оствальда

сн = снсоо = 0,01*1,34*10-1 = 1,34*10-3.
Пример 3. Вычислите водородный показатель (pH) раствора и концентрации Н+ и ОН- раствора гидроксида калия, содержащего 0,056 г КОН в 100 мл раствора (α = 1).
Решение.
Находим концентрацию раствора КОН в молях. Молярная масса КОН равна 56 г.

Находим, сколько молей КОН содержится в 1 л раствора.
В 100 мл раствора содержится 0,001 моль КОН.
В 1000 мл раствора содержится х моль КОН,
х = 0,01 моль
Концентрация КОН (сКОН) равна 0,01 моль/л.
Концентрация ОН- - ионов равна сКОН = 0,01 моль/л.
рОН раствора рассчитываем по формуле
 ,
,
Для
расчета
 определяем ионную силу раствора
определяем ионную силу раствора
I = 1/2 ∑ci * zi2 = 1/2 (cK*zK2 + cOH * zOH2 ) = 1/2 (0,01 * 12 + 0,01* 12) = 0,01.
Из
табл. П 6 находим
 =
0,90. Следовательно, рОН =
=
0,90. Следовательно, рОН =
 (0,90
* 0,01) = 2,05.
(0,90
* 0,01) = 2,05.
рН = рКВ – рОН = 14 – 2,05 = 11,95.
Пример 4. Составьте молекулярные и ионное уравнения гидролиза солей: а) нитрата аммония NH4NO3; б) сульфита лития Li2SO3; в) ацетата алюминия Al(CH3COO)3; напишите выражение для контастанты гидролиза и оцените рН среды.
Решение.
а) При растворении в воде соль NH4NO3 диссоциирует
NH4NO3
NH4+
+ NO3-.
Ионы воды (Н+ и ОН-) в малодиссоциирующее соединения связывает ион NH4+, образуя молекулы слабого основания NH4ОН.
Ионное уравнение гидролиза NH4NO3
NH4+
+ H2O
NH4OH
+ H+.

где
 - константа диссоциации NH4ОН.
- константа диссоциации NH4ОН.
Уравнение гидролиза в молекулярной форме
NH4NO3
+
H2O
NH4OH
+ HNO3.
Реакция среды кислая, рН < 7.
б) Сульфит лития при растворении в воде диссоциирует
Li2SO3
2Li+
+ SO32-.
Ионы SO32- связывают H+ - ионы воды ступенчато, образуя кислые ионы HSO3- и молекулы слабой кислоты H2SO3. Практически гидролиз соли ограничивается первой ступенью
SO32-
+
H2O
HSO3-
+
OH-,
Li2SO3
+ H2O
NaHSO3
+ NaOH.

Рекция раствора щелочная, рН > 7.
в) Соль ацетата алюминия диссоциирует, образуя ионы
Al(CH3COO)3
Al+3
+ 3CH3COO-
Ионы Al+3 и ион CH3COO- взаимодействуют с ионами воды, образуя малорастворимые соединения Al(OH)3 и взаимодействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью.
Al(CH3COO)3
+ 3H2O
= Al(ОН3)
+ 3 CH3COO.

pH
раствора Al(CH3COO)3
зависит
от соотношения
 и
и
 .
Из табл.П 4 следует, что
.
Из табл.П 4 следует, что
 <
<
 ,
следовательно среды кислая.
,
следовательно среды кислая.
Пример 5. Образуется ли осадок труднорастворимого соединения CaSO4, если смешать равные объемы растворов Сa(NO3)2 и K2SO4 с молярной концентрацией 0,003 моль/л?
Решение.
При смещении равных объемов раствора объем стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое, то есть
 ;
;
 .
.
Концентрации ионов Са2+, NO3-, K+ и SO42- соответственно равны
 ;
;
 ;
;

 .
.
Ионная сила раствора равна
I
= 1/2 (
Учитывая
коэффиценты активности для
 и
и
 (табл.П 6), рассчитываем активности этих
ионов в растворе
(табл.П 6), рассчитываем активности этих
ионов в растворе
 ;
;
 значит
осадок не образуется.
значит
осадок не образуется.
Пример 6. Свойства растворов неэлектролитов и законы Рауля.
-
Осмотическое давление растворов π определяют согласно закону Ванг-Гоффа

где
 количество растворенного вещества,
моль;
количество растворенного вещества,
моль;
V – объем раствора, м3
 -
молярная газовая постоянная, равная
8,3144 Дж/моль*К.
-
молярная газовая постоянная, равная
8,3144 Дж/моль*К.
Зная π, можно определить молярную массу неэлектролита (М)
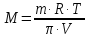
где – m – масса растворенного вещества.
-
Давление пара над раствором нелетучего вещества в растворителе (р) ниже давления пара над чистым растворителем (р0) при той же температуре.
Согласно закону Рауля

Зная относительное понижение давления пара растворителя над раствором, можно вычислить молярную массу неэлектролита

где
-
 число
молей и массы растворителя и неэлетролита,
соответственно;
число
молей и массы растворителя и неэлетролита,
соответственно;
 -
молярные массы растворителя и
неэлектролита.
-
молярные массы растворителя и
неэлектролита.

-
Вычисление молекулярной массы неэлектролита по понижению температуры замерзания или по повышению температуры кипения растворов неэлектролитов.
По закону Рауля
 ;
;
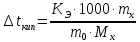 ,
,
где
-
 – понижение температуры замерзания и
повышение температуры кипения раствора
соответственно;
– понижение температуры замерзания и
повышение температуры кипения раствора
соответственно;
 скопическая
константа растворителя;
скопическая
константа растворителя;
 -
эбуллиоскопическая константа растворителя;
-
эбуллиоскопическая константа растворителя;
 вещества;
вещества;
 масса
растворителя;
масса
растворителя;
 – молярная масса растворенного вещества.
– молярная масса растворенного вещества.
 ;
;
 .
.
Задачи для выполнения контрольной работы
5.1
Найдите массу соли, необходимую для
приготовления раствора объемом V
л с массовой долей
 .
Плотность раствора
.
Плотность раствора
 Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
молярность и титр этого раствора.
Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
молярность и титр этого раствора.
Таблица 5.1
|
Вариант |
Соль |
V, л |
|
|
|
161 |
AlCl3 |
0,5 |
6 |
1052 |
|
162 |
AgNO3 |
1,5 |
8 |
1069 |
|
163 |
AgNO3 |
0,8 |
6 |
1050 |
|
164 |
Al2(SO4)3 |
0,8 |
6 |
1061 |
|
165 |
Al2(SO4)3 |
1,5 |
4 |
1040 |
|
166 |
BaCl2 |
3,0 |
4 |
1034 |
|
167 |
BaCl2 |
0,3 |
2 |
1015 |
|
168 |
CaCl2 |
0,5 |
12 |
1083 |
|
169 |
CaCl2 |
0,9 |
4 |
1031 |
|
170 |
CuSO4 |
2,5 |
8 |
1084 |
|
171 |
CuSO4 |
0,65 |
2 |
1019 |
|
172 |
FeCl3 |
0,9 |
12 |
1085 |
|
173 |
FeCl3 |
1,7 |
6 |
1049 |
|
174 |
FeSO4 |
1,5 |
4 |
1037 |
|
175 |
FeSO4 |
3,5 |
8 |
1078 |
|
176 |
K2CO3 |
2,0 |
12 |
1090 |
|
177 |
K2CO3 |
0,6 |
2 |
1016 |
|
178 |
K2Cr2O7 |
2,5 |
8 |
1055 |
|
179 |
K2Cr2O7 |
0,4 |
6 |
1040 |
|
180 |
K2SO4 |
3,0 |
6 |
1047 |
|
181 |
K2SO4 |
1,2 |
12 |
1081 |
|
182 |
MgSO4 |
4,0 |
4 |
1039 |
|
183 |
MgSO4 |
1,6 |
6 |
1060 |
|
184 |
Na2CO3 |
0,5 |
12 |
1102 |
|
185 |
Na2CO3 |
3,5 |
2 |
1019 |
|
186 |
Na2SO4 |
3,5 |
8 |
1072 |
|
187 |
Na2SO4 |
1,7 |
6 |
1053 |
|
188 |
Pb(NO3)2 |
1,5 |
6 |
1052 |
|
189 |
Pb(NO3)2 |
2,5 |
8 |
1072 |
|
190 |
Pb(NO3)2 |
0,5 |
12 |
1016 |
5.2. Напишите уравнение электролитической диссоциации раствора слабой кислоты и найдите концентрации ионов Н+ и кислотного остатка в моль/л в растворе нормальной концентрации с, если известна константа диссоциации Кдисс.
Таблица 5.2
|
Вариант |
Формула кислоты |
Название кислоты |
с,моль/л |
Кдисс |
|
191 |
HCOOH |
Муравьиная |
0,005 |
1,8 |
|
192 |
CH3COOH |
Уксусная |
0,005 |
1,74 |
|
193 |
HNO2 |
Азотистая |
0,05 |
5,1 |
|
194 |
C6H6COOH |
Бензойная |
0,05 |
6,6 |
|
195 |
HIO4 |
Иодная |
0,005 |
2,8 |
|
196 |
HIO3 |
Иодноватая |
0,001 |
1,6 |
|
197 |
HF |
Плавиковая |
0,01 |
6,8 |
|
198 |
HCN |
Синильная |
0,1 |
6,2 |
|
199 |
HBrO |
Бромноватистая |
0,1 |
2,5 |
|
200 |
C2H5COOH |
Пропионовая |
0,01 |
1,35 |
|
201 |
HCNS |
Роданисто-водородная |
0,001 |
1,4 |
|
202 |
C6H4(OH)COOH |
Салициловая |
0,001 |
1,1 |
|
203 |
HClO2 |
Хлористая |
0,001 |
1,1 |
|
204 |
HClO |
Хлорноватистая |
0,05 |
5,0 |
|
205 |
HCNO |
Циановая |
0,01 |
3,5 |
|
206 |
HCOOH |
Муравьиная |
0,02 |
1,8 |
|
207 |
CH3COOH |
Уксусная |
0,01 |
1,74 |
|
208 |
HNO2 |
Азотистая |
0,01 |
5,1 |
|
209 |
C6H5COOH |
Бензойная |
0,01 |
6,6 |
|
210 |
HIO4 |
Йодная |
1,0 |
2,8 |
|
211 |
HIO3 |
Йодноватая |
2,0 |
1,6 |
|
212 |
HF |
Плавиковая |
0,05 |
6,8 |
|
213 |
HCN |
Синильная |
0,5 |
6,2 |
|
214 |
HBrO |
Бромноватистая |
0,5 |
2,5 |
|
215 |
C2H5COOH |
Пропионовая |
0,05 |
1,35 |
|
216 |
HCNS |
Роданистово-дородная |
2,0 |
1,4 |
|
217 |
C6H4(OH)COOH |
Салициловая |
1,0 |
1,1 |
|
218 |
HClO2 |
Хлористая |
1,0 |
1,1 |
|
219 |
HClO |
Хлорноватистая |
0,1 |
5,0 |
|
220 |
HCNO |
Циановая |
0,05 |
3,5 |
5.3
Рассчитайте рН
раствора соединения (кислоты или
основания) и концентрации ионов Н+
и ОН-
в растворе, содержащем m
г соединения в объеме V
мл расвтора ( = 1).
= 1).
Таблица 5.3
|
Вариант |
Соединения |
V, мл |
m, г |
|
221 |
HCl |
1000 |
1,46 |
|
222 |
HCl |
500 |
0,365 |
|
223 |
HCl |
2000 |
0,73 |
|
224 |
HCl |
250 |
0,365 |
|
225 |
NaOH |
500 |
0,04 |
|
226 |
NaOH |
100 |
0,02 |
|
227 |
NaOH |
250 |
0,1 |
|
228 |
NaOH |
1000 |
0,40 |
|
229 |
KOH |
1000 |
0,56 |
|
230 |
KOH |
500 |
0,112 |
|
231 |
KOH |
250 |
0,112 |
|
232 |
KOH |
2000 |
1,12 |
|
233 |
HI |
2000 |
2,56 |
|
234 |
HI |
1000 |
0,256 |
|
235 |
HI |
500 |
1,28 |
|
236 |
HI |
250 |
0,0256 |
|
237 |
HBr |
1000 |
1,62 |
|
238 |
HBr |
500 |
0,81 |
|
239 |
HBr |
250 |
0,81 |
|
240 |
HBr |
2000 |
0,162 |
|
241 |
NaOH |
500 |
0,2 |
|
242 |
NaOH |
250 |
0,4 |
|
243 |
NaOH |
1000 |
0,8 |
|
244 |
NaOH |
1500 |
6,0 |
|
245 |
KOH |
1500 |
8,4 |
|
246 |
KOH |
500 |
2,8 |
|
247 |
KOH |
750 |
1,68 |
|
248 |
KOH |
1000 |
0,28 |
|
249 |
HCl |
500 |
1,46 |
|
250 |
HCl |
250 |
0,73 |
5.4. Составьте ионное и молекулярное уравнение реакции гидролиза соли, выражение для константы гидролиза и оцените величину рН раствора.
Таблица 5.4
|
Вариант |
Соль |
Вариант |
Соль |
|
251 |
AgNO3 |
266 |
K2CO3 |
|
252 |
AlCl3 |
267 |
K2SO3 |
|
253 |
CdBr2 |
268 |
Na2CO3 |
|
254 |
Al(NO3)3 |
269 |
Na2SO3 |
|
255 |
Cd(NO3)2 |
270 |
Na2S |
|
256 |
Col2 |
271 |
NaNO2 |
|
257 |
(NH4)2S |
272 |
Al2S3 |
|
258 |
Co(NO3)2 |
273 |
CuCl2 |
|
259 |
Cu(NO3)2 |
274 |
FeCl2 |
|
260 |
FeSO4 |
275 |
Fe(NO3)3 |
|
261 |
FeCl3 |
276 |
MnSO4 |
|
262 |
NH4NO3 |
277 |
K2S |
|
263 |
KNO2 |
278 |
NaCN |
|
264 |
KClO |
279 |
FeCO3 |
|
265 |
HCOOK |
280 |
CH3COONa |

 ,%
,% ,кг/м3
,кг/м3 10-4
10-4 10-5
10-5 10-4
10-4 10-5
10-5 10-2
10-2 10-1
10-1 10-4
10-4 10-10
10-10 10-9
10-9 10-5
10-5 10-1
10-1 10-3
10-3 10-2
10-2 10-8
10-8 10-4
10-4 10-4
10-4 10-5
10-5 10-4
10-4 10-5
10-5 10-2
10-2 10-1
10-1 10-4
10-4 10-10
10-10 10-9
10-9 10-5
10-5 10-1
10-1 10-3
10-3 10-2
10-2 10-5
10-5 10-4
10-4