
- •1. Простейшие стехиометрические расчеты
- •Задания для выполнения контрольной работы
- •2. Строение атома.
- •3. Химическая связь. Примеры решения типовых задач
- •4. Основные понятия о химической кинетике. Примеры решения типовых задач
- •5. Растворы электролитов
- •6. Основы электрохимии. Примеры решения типовых задач
- •7. Классификация неорганических веществ. Примеры решения типовых задач
- •Варианты контрольных заданий
- •Список литературы
3. Химическая связь. Примеры решения типовых задач
Пример 1.
Задание 3.1. Для двух, указанных по варианту молекул с позиций метода валентных связей показать образование молекул и ответить на следующие вопросы:
3.1.1 Каков тип гибридизации центрального атома в молекуле и валентный угол между связями?
3.1.2
Сколько
 связей
содержит молекула?
связей
содержит молекула?
3.1.3. Определить полярность связей и полярность молекулы в целом.
3.1.4. Какова пространственная структура молекулы?
Для ответа на вопросы задания рассмотрим молекулу CdI2.
3.1.1.Сначала определяем тип гибридизации центрального атома. Для этого выписываем валентные элекроны центрального атома 48Cd.
5s


















4d
Затем
электроны переводим в возбужденное
состояние


5p

5s

4d







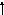







Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s- и р-орбитали на рис. 2.1.

Рис.2.1
Далее «проводим» валентные электроны 53I. Так как I – p- элемент, то на рис. 2.1 к электронам Cd подрисовываем гантелеобразные p- орбитали йода,получаем схему молекулы CdI2 (рис. 2.2)

Как видно из рис. 2.2 силы отталкивания между электронными орбиталями на участках I и II сильно различаются. С одной р- орбиталью йода кадмий связывается с помощью s-орбитали, а с другой - с помощью p-орбитали. Связи отличаются по форме и энергии. Такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис 2.3.

Рис. 2.3
Гибридизация – это процесс,в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Таким образом, s + р = 2sp; по аналогии: s + р + р = 3sp2; s + р +
+ р + р + р = 4sp . Гибридные орбитали центрального атома - это заряженные поля и, отталкиваясь, они располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 sp2 - 120 sp3 - 109 Расположение гибридных орбиталей согласно этим валентным углам показано в табл. 2.1.
Таблица 2.1
|
Тип гибридизации: |
sp |
sp2 |
sp3 |
|
Расположение гибридных орбиталей в пространстве |
|||
|
Теоретический валентный угол |
1800 |
1200 |
1090 |

В соответствии с данными табл. 2.1 в молекуле Cdl2 реализуется sp-гибридизация, и валентный угол составляет 1800.
Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р-элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s-элемент, форма орбитали имеет вид шара.
"Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.4).
I Cd I
Рис.
2.4![]()
π - тип
Рис.
2.5
В случае CdI2 в молекуле две ковалентные связи сигма – типа.
Определим полярность. Полярность связана с наличием диполя, обусловленного оттягиванием валентных электронов в сторону более электроотрицательного атома (Приложение 1). В случае молекулы CdI2 более электроотрицательным элементом является йод. Поэтому связь Cd-I является полярной. Однако в целом молекула неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
3.1.3. Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации центрального атома и расположением боковых атомов вокруг центрального атома (табл. 2.2).
Таблица 2.2
|
Тип гибридизации |
sp |
sp2 |
sp3 |
sp3 |
sp3 |
|
Пространственная структура (форма) молекулы |
линейная |
треуголь-ная |
тетраэдрическая |
пирамидальная |
угловая |
Как видно из табл. 2.2 при sp3 гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 - соответственно). Из рис. 2.4 следует, что молекула CdI2 имеет линейную форму.
Рассмотрим еще одну молекулу OF2. Выписываем валентные электроны центрального атома - кислорода.
2p










2s
Далее надо перевести в возбужденное состояние. Однако, так как во втором слое нет свободных (пустых) орбиталей, эту операцию пропускаем. Если в качестве центрального атома будет похожий элемент, но находящийся в третьем периоде, то для таких простых молекул, которые предлагаются в задании не следует при возбуждении переводить электроны с 3s и 3p на 3d,так как на это необходимы большие затраты энергии.
Определяем тип гибридизации. Для этого производим «сложение»: s + p + p +p =4sp3 . при этом не следует писать 2s или 2p, так как речь идет не об электронах (на 2s подуровне), а их действительно 2, а об орбиталях, т.е пространства вероятного нахождения электронов. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали F (это – p- элемент). Получаем угловую молекулу с теоретическим валентным углом 1090 (рис.2.7)

Отдельные
связи О-F
- полярные, молекула в целом тоже полярна,
так как в вершине угла заряд со знаком
"+", а в противоположной стороне
" ".
Происходит оттягивание электронов в
сторону F,
т.е. образуется диполь.
".
Происходит оттягивание электронов в
сторону F,
т.е. образуется диполь.
Задачи для выполнения контрольной работы
3.1.
С позиции метода ВС покажите образование
предложенной молекулы. Какие орбитали
соединяющихся атомов участвуют в
образовании связей? Сколько
 связей содержит молекула? Какова
пространственная структура молекулы?
Каков тип гибридизации центрального
атома в указанном соединении (если
есть)? Отметьте полярность связей и
полярность молекулы вцелом.
связей содержит молекула? Какова
пространственная структура молекулы?
Каков тип гибридизации центрального
атома в указанном соединении (если
есть)? Отметьте полярность связей и
полярность молекулы вцелом.
|
Вариант |
Молекула |
Вариант |
Молекула |
|
41 |
H2O |
47 |
C2H2 |
|
42 |
PH3 |
48 |
SiF4 |
|
43 |
Cl2 |
49 |
OF2 |
|
44 |
O2 |
50 |
PCl3 |
|
45 |
NH3 |
51 |
AsH3 |
|
46 |
CF4 |
52 |
SbH3 |
|
53 |
BeBr2 |
62 |
BeI2 |
|
54 |
H2S |
63 |
SO2 |
|
55 |
N2 |
64 |
H2Te |
|
56 |
SiH4 |
65 |
HI |
|
57 |
BCl3 |
66 |
I2 |
|
58 |
H2Se |
67 |
C2H2 |
|
59 |
HBr |
68 |
CCl4 |
|
60 |
Br2 |
69 |
AlCl3 |
|
61 |
CO2 |
70 |
COCl2 |
3.2. Используя значение относительной электроотрицательности атомов, расположите соединения в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему?
|
Вариант |
Соединение |
Вариант |
Соединение |
|
71 |
NH3,PH3,AsH3,SbH3 |
86 |
LiCl,NaCl,KCl,RbCl |
|
72 |
BeF2,BF3,CF3,NF3 |
87 |
BeF2,MgF2,CaF2,BaF2 |
|
73 |
H2O,H2S,H2Se,H2Te |
88 |
Rb2S,K2S,Na2S,Li2S |
|
74 |
CF4,NF3,OF2,F2 |
89 |
MnCl2,FeCl2,NiCl2,MgCl2 |
|
75 |
NaF.NaCl,NaBr,NaI |
90 |
OF2,TeF2,SeF2,SF2 |
|
76 |
H2O,Li2O,Na2O,K2O |
91 |
LiF,NaCl,KBr,RbI |
|
77 |
BeO,MgO,CaO,SrO |
92 |
BaI2,CaBr2,MgCl2,BeF2 |
|
78 |
CO2,SiO2,GeO2,SnO2 |
93 |
AlCl3,GaBr3,BF3,InI3 |
|
79 |
BeO,B2O3,CO2,NO2 |
94 |
CF4,GeBr4,SnI4,SiCl4 |
|
80 |
BH3,CH4,NH3,OH2 |
95 |
RbCl,SrCl2,InCl3,SnCl2 |
|
81 |
NaCl,MgCl2,AlCl3,SiCl4 |
96 |
SnCl4,SbCl3,TeCl2,ICl |
|
82 |
N2O,NO,NO2,N2O4 |
97 |
NaCl,CuCl,AgCl,AuCl |
|
83 |
B2O3,Al2O3,Ga2O3,InO3 |
98 |
Ta2O5,Nb2O5,As2O5,P2O5 |
|
84 |
Al2O3,SiO2,P2O5SO2 |
99 |
PbO2,SnO2,ZrO2,TiO2 |
|
85 |
SiH4,PH3,H2S,HCl |
100 |
SnI4,GeBr4,TiBr4,SiCl4 |
