
- •Содержание курса химии:
- •Основные понятия и законы химии.
- •Для простых веществ:
- •Масса эквивалента соли
- •Закон Авогадро.
- •Строение вещества.
- •Модель атома вещества по Бору.
- •Квантово механическая модель атома.
- •Основной принцип квантовой механики.
- •Квантовые числа.
- •Распределение электронов в атоме по энергетическим состояниям.
- •Принцип Паули.
- •Энергия ионизации, сродство к электрону и Электроотрицательность.
- •Строение молекул. Химическая связь.
- •Природа и свойства ковалентной связи на примере строения молекул (h2, hCl, h2o).
- •Свойства ковалентной связи:
- •Ионная связь.
- •Влияние природы химической связи на свойства веществ.
- •Металлическая связь, сходство и различие между металлической и ковалентной связями.
- •Основные закономерности протекания химических реакций. Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
- •Основные понятия и законы в термодинамике.
- •Стандартное состояние.
- •Термохимические законы и расчёты по ним:
- •Закон Гесса.
- •2. Закон Лавуазье-Лапласа.
- •Направленность химических реакций.
- •Кинетика химических реакций. Основные понятия химической кинетики.
- •Скорость реакции.
- •Смещение равновесий.
- •Особенности кинетики гетерогенных реакций.
- •Дисперсные системы.
- •Растворы.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Кислоты, основания, соли с точки зрения теории электрической диссоциации.
- •Слабые электролиты.
- •Ионное произведение воды. Водородный показатель.
- •Гидролиз солей.
- •Окислительно-восстановительные реакции.
- •Электрохимия.
- •Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Химические источники тока.
- •Стаканчиковый
- •Аккумуляторы.
- •Ряд напряжений металлов.
- •Измерение электродных потенциалов. Ряд стандартных электродных потенциалов, водородный электрод.
- •Электролиз расплавов и растворов электролитов.
- •Явление поляризации при электролизе. Природа этого явления.
- •Последовательность разрядки ионов при электролизе на катоде.
- •Электролиз водных растворов электролитов.
- •Законы Фарадея.
- •Коррозия металла.
- •Защита металлов от коррозии.
Растворы.
Раствор - однородная смесь двух или более компонентов относительное содержание которых изменяется во всех объемных пределах и может изменятся в широких пределах.
Концентрация растворённого вещества – относительное содержание растворенного вещества в растворе. Так как содержание веществ характеризуется по массе, по количествам, по объёму и точно также отображает состояние растворителя, растворённого вещества, растворов.
1) Массовая доля растворённого вещества (ω(В), где В – формула растворённого вещества)
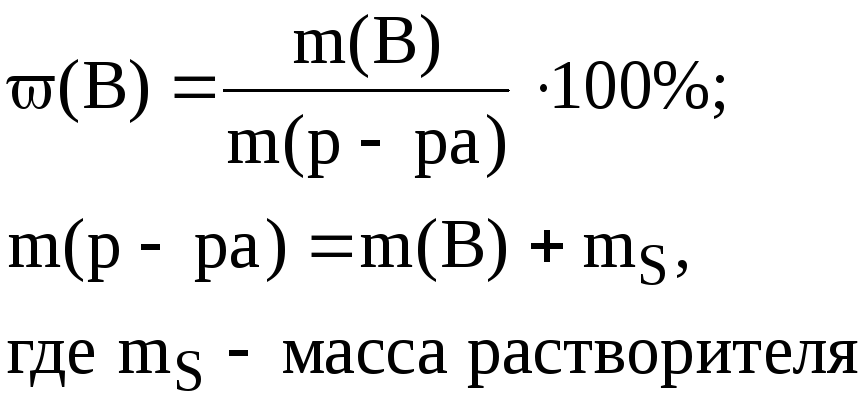
На практике можно измерить плотность любого раствора (ρ) используя ареометр.
![]()
2) Молярная концентрация.
![]()
3) Ковалентная концентрация
![]()
![]() -
моляльность.
-
моляльность.
Применение закона эквивалента для реакции идущих в растворах.
Пример: реакция нейтрализации: ее используют для определения содержания кислот или щелочей в различных жидких системах, путем определения их концентрации.

Законы Рауля.
1.Тонаскапический закон: понижение давления (∆p) насыщенного пара над раствором по сравнению с чистым растворителем прямопропорционален числу моль растворенного вещества и обратно пропорционален количеству растворителя.
![]()
p0 – давление насыщенного пара над растворителем (например вода), p - давление насыщенного пара над раствором, n – количество растворенного вещества, N – количество растворителя.
2. Эбулиоскапический – повышение температуры кипения раствора по сравнению с чистым растворителем (∆T) прямопропорционально молярной концентрации раствора.
![]() ; T0
– температура
кипения чистого растворителя; T
– температура кипения раствора.
; T0
– температура
кипения чистого растворителя; T
– температура кипения раствора.
∆Tкип=Kэб Сm ; Kэб=const – эбулеотостатическая константа (справочная величина характерная для растворителя).
3. Криоскопический (крио-холод) – изменение температуры замерзания раствора по сравнению с чистым растворителем пропорционален молярной концентрации.
∆Tзам=Kкр
Сm ![]() T0
– температура
замерзания растворителя, T
– температура замерзания раствора.
T0
– температура
замерзания растворителя, T
– температура замерзания раствора.
Kкр=const – криоскопическая константа (справочная величина).
Изменение температуры замерзания в смеси веществ тепловые эффекты при смешивании веществ используются в технике для приготовления систем охлаждающих жидкости.
Эти законы соблюдаются для растворов, где между молекулами растворителя распределены молекулы растворенного вещества (молекулярный раствор) и они не соблюдаются для растворов кислот, щелочей и солей.
Энергетические эффекты при растворении.
Процессы растворения – физико-химические процессы. Их физическая частота заключается в том, что растворение связано с распределением структурных единиц одного вещества между структурными единицами другого. Для этого необходимы затраты энергии.
-
Теплосодержание (энтропия ) увеличивается, если
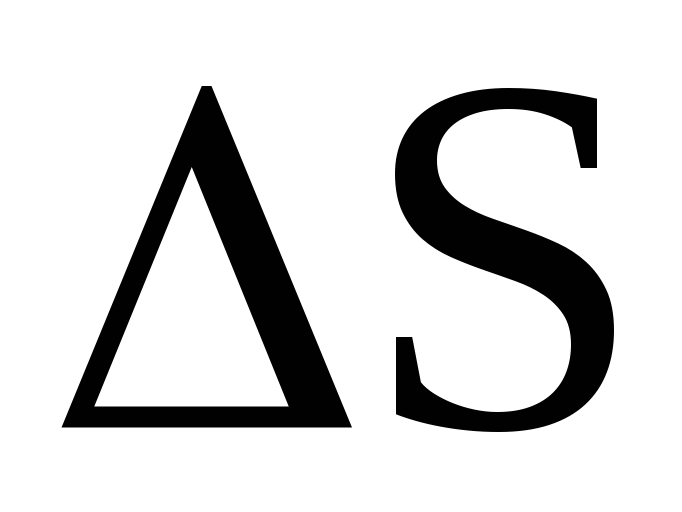 >0,
H2>H1
,
>0,
H2>H1
,
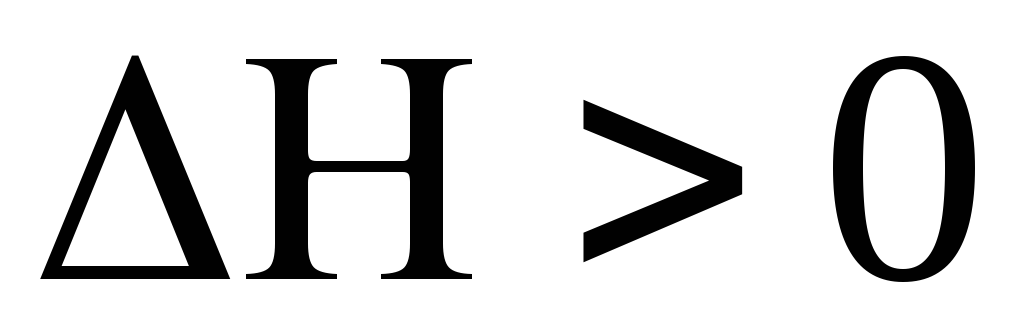 ;
; -
Химическая сторона при растворении имеет место взаимодействия между молекулами растворенного вещества и растворителя. Если растворитель вода он называется гидротацией.
![]()
Электролитическая диссоциация.
Законы Рауля не соблюдаются для растворов кислот, оснований и солей.
Пример: если приготовить одномолярный раствор KCl, то температура его замерзания будет приблизительно равна –3,5˚С (должна быть равна -2˚С).
