
- •Часть 1
- •1. Техника безопасности работы в лаборатории
- •1.1. Порядок работы в химической лаборатории. Техника эксперимента
- •1.1.1. Меры предосторожности при работе с кислотами и щелочами
- •1.1.2. Правила безопасности при работе с пробирками
- •1.1.3. Оказание первой помощи при несчастных случаях
- •2. Классы химических соединений
- •2.1. Оксиды
- •2.2. Кислоты
- •2.3. Основания
- •2.4. Соли
- •Лабораторная работа № 1. Классы химических соединений
- •1. Основания
- •2. Кислоты
- •3. Соли
- •4. Оксиды
- •3. Теория электролитической диссоциации
- •3.1. Диссоциация кислот, оснований и солей
- •3.2. Ионные уравнения реакций
- •Лабораторная работа № 2. Электролитическая диссоциация
- •2. Реакции между растворами электролитов
- •3. Различие между ионами.
- •4. Номенклатура неорганических веществ
- •4.1. Бинарные (идо-) соединения
- •4.2. Псевдобинарные соединения
- •Лабораторная работа №3. Получение малорастворимых гидроксидов и сульфидов с помощью обменных реакций
- •5. Комплексные (координационные) соединения
- •5.1. Изомерия комплексных соединений
- •5.2. Равновесия в растворах комплексных соединений
- •5.3. Классификация комплексных соединений
- •5.4. Способы получения комплексных соединений
- •5.5. Номенклатура комплексных (ато-) соединений
- •Лабораторная работа № 4. Получение комплексных соединений
- •6. Получение гексацианоферратных комплексов железа (II) и железа (III).
- •6. Окислительно-восстановительные реакции
- •6.1. Подбор коэффициентов окислительно-восстановительных реакций
- •6.2. Метод электронного баланса
- •6.3. Метод полуреакций
- •6.4. Контрольные задания для самостоятельной подготовки
- •Лабораторная работа №5. Окислительно-восстановительные реакции в кислой среде
- •6.5. Влияние среды на характер протекания реакций
- •Лабораторная работа № 6. Окислительно-восстановительные реакции в щелочной среде
- •7. Растворы. Способы выражения концентрации
- •7.1. Важнейшие понятия и определения
- •7.2. Примеры решения типовых задач
- •7.3. Контрольные вопросы и задачи для самостоятельной подготовки по теме «Способы выражения концентрации» Вопросы для индивидуальной подготовки
- •Лабораторная работа № 7. Способы выражения концентрации раствора. Приготовление раствора заданной концентрации
- •Приложение
- •Плотность водных растворов Na2co3 при 20оС, г/см3
- •Плотность водных растворов Al2(so4)3 при 20оС, г/см3
- •Плотность водных растворов Al(no3)3 при 20оС, г/см3
- •Плотность водных растворов MgSo4 при 20оС, г/см3
- •Плотность водных растворов CaCl2 при 20оС, г/см3
- •Плотность водных растворов FeCl3 при 20оС, г/см3
- •Плотность водных растворов MnCl2 при 20оС, г/см3
- •Плотность водных растворов MnSo4 при 20оС, г/см3
- •Плотность водных растворов NaCl при 20оС, г/см3
- •Список литературы
7.2. Примеры решения типовых задач
Пример 1. 17,5 г CuSO4 растворено в 420 мл воды. Рассчитайте массовую долю, моляльную и молярную концентрации и титр полученного раствора, если его плотность ρ = 1,04 г/мл.
Решение. При решении задачи необходимо использовать приведенные выше формулы для расчета различных способов выражения концентрации раствора.
Определение массовой доли ω(CuSO4) в %
1. Найдем массу полученного раствора:
так как ρ(Н2О) = 1 г/мл, то m(Н2О) = ρ(Н2О) ∙ V(Н2О) = 1 г/мл ∙ 420 мл = 420 г,
mр-ра = m(CuSO4) + m(Н2О) = 17,5 + 420 = 437,5 г.
2. Рассчитаем массовую долю CuSO4 в полученном растворе (в %). Воспользуемся формулой (7.1.2):
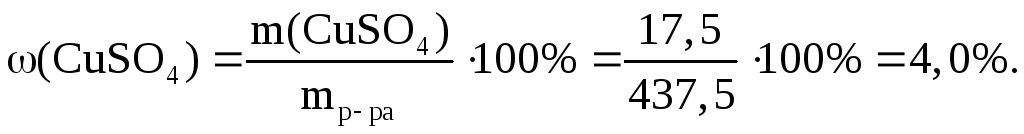
![]()
Определение моляльной концентрации раствора
Для расчета моляльной концентрации воспользуемся формулой (7.1.5).
-
Масса растворителя (воды) в килограммах равна:
m(H2O) = 420 г = 0,42 кг.
-
Число моль CuSO4 в растворе равно:
n(CuSO4)
=
![]() моль.
моль.
-
Моляльная концентрация раствора CuSO4 равна:
![]() моль/(кг H2O).
моль/(кг H2O).
Определение молярной концентрации раствора
Для расчета молярной концентрации воспользуемся формулой (7.1.6).
1. Найдем объем раствора CuSO4 в литрах:
![]() 420,7
мл = 0,4207 л.
420,7
мл = 0,4207 л.
2. Так как количество вещества CuSO4 нам уже известно, мы можем найти молярную концентрацию данного раствора:
![]() моль/л.
моль/л.
Определение титра раствора
Для расчета титра воспользуемся формулой (7.1.12):
![]() г/мл.
г/мл.
Пример 2. Какой объем раствора КОН с массовой долей ω(КОН) = 5% и плотностью 1,04 г/мл требуется для полного осаждения ионов железа Fe3+ из 50 мл раствора FeCl3 с массовой долей ω(FeCl3) = 10% и плотностью 1,09 г/мл?
Решение.
-
Найдем массу раствора FeCl3:
![]() г.
г.
-
Определим массу FeCl3, содержащегося в 50 мл 10%-го раствора:
![]() г.
г.
3. По уравнению реакции
3КОН + FeCl3 = Fe(OH)3↓ + 3KC1
3∙56 г 162,5 г
вычисляем массу КОН, необходимого для реакции с содержащимся в растворе FeCl3:
162,5 г FeCl3 взаимодействуют с 168 г КОН;
5,45 г FeCl3 ––––"–––– m г КОН;
![]() г.
г.
-
Зная массу КОН, концентрацию раствора и его плотность, вычисляем массу и объем раствора КОН:
![]() г.
г.
![]() мл.
мл.
Пример 3. Для нейтрализации 70 мл раствора соляной кислоты потребовалось 200 мл 0,3 Н раствора NaOH. Какова молярная концентрация эквивалента HCl?
Решение. Эту задачу следует решать, используя соотношение:
Cэк(HCl) ∙ V(HCl) = Cэк(NaOH) ∙ V(NaOH),
из которого получаем:
![]() моль/л,
моль/л,
следовательно, данный раствор соляной кислоты имеет молярную концентрацию эквивалента 0,86 Н.
Примечание. Молярную концентрацию эквивалента вещества необходимо рассматривать применительно к реакциям. Так, например, при полной нейтрализации серной кислоты гидроксидом натрия:
H2SO4 + 2NaOH = Na2SO4 + 2Н2О
число эквивалентности z*(H2SO4) = 2; эквивалент Э(Н2SО4) = 1/2 ФЕ(H2SO4), а молярная масса эквивалента
![]()
Следовательно, в данном случае 1 Н раствором H2SO4 будет раствор, в литре которого содержится 49 г H2SO4.
Для реакции частичной нейтрализации и неполного обмена эквивалент H2SO4 будет определяться реакцией:
H2SO4 + NaOH = NaHSO4 + Н2О,
z*(H2SO4) = 1; Э(Н2SO4) = ФЕ(H2SO4), а
![]()
Поэтому в данном случае 1 Н раствором H2SO4 будет раствор, в литре которого содержится 98 г H2SO4.
Пример 4. Рассчитайте молярную концентрацию эквивалента следующих растворов: раствор АlСl3 с молярной концентрацией 0,2 моль/л; раствор Н3РО4 с молярной концентрацией 0,6 моль/л; раствор Сr2(SО4)3 с молярной концентрацией 0,7 моль/л, принимая максимальное значение числа эквивалентности.
Решение. Воспользуемся соотношением: Сэк(В) = z*(B) ∙ C(B).
Чтобы перейти от молярной концентрации вещества к молярной концентрации эквивалента, нужно молярную концентрацию C(В) умножить на число эквивалентности z*(B).
При обратном переходе молярную концентрацию эквивалента необходимо разделить на число эквивалентности z*(B).
Для электролитов, состоящих из однозарядных катионов и анионов (NaCl, КОН, HI и др.), молярная концентрация вещества равна молярной концентрации эквивалента вещества, т.к. у них z*(B) = 1. Для сложных электролитов (АlСl3, Н3РО4, Сr2(SО4)3 и др.) молярная концентрация эквивалента Сэк(В) больше, чем молярная концентрация вещества С(В), т.к. у них z*(B) > 1.
Для солей АlСl3 и Сr2(SО4)3, приведенных в условии задачи, число эквивалентности определяется по числу положительных или отрицательных зарядов в молекуле, для Н3РО4 – по основности кислоты. Отсюда следует, что z*(АlСl3) = 3; z*(Сr2(SО4)3) = = 3∙2 = 6; z*(Н3РО4) = 3. Следовательно, их молярная концентрация эквивалента будет равна:
Сэк(АlСl3) = 0,2 ∙ 3 = 0,6 моль/л;
Сэк(Н3РО4) = 0,6 ∙ 3 = 1,8 моль/л;
Сэк(Сr2(SО4)3) = 0,7 ∙ 3 ∙ 2 = 4,2 моль/л.
Пример 5. Приготовить 70 мл раствора с массовой долей ω(H2SO4) = 63% (ρ = = 1,535 г/мл) путем смешения растворов с массовой долей ω1(H2SO4) = 82% (ρ1 = = 1,755 г/мл) и с массовой долей ω2(H2SO4) = 34% (ρ2 = 1,255 г/мл).
Решение. Задачу удобней решать по правилу смешения (правилу креста), согласно которому массы смешиваемых растворов обратно пропорциональны разностям концентраций смеси и отдельных ее компонентов.
1. Записываем друг под другом массовые доли исходных растворов, а правее между ними массовую долю раствора, который необходимо приготовить. Затем из большей массовой доли вычитаем заданную и записываем результат справа внизу; из заданной массовой доли вычитаем меньшую и записываем результат справа вверху:
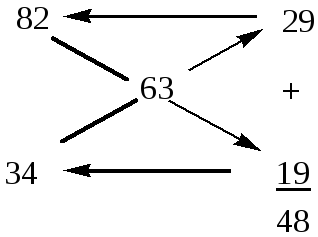
![]()
Числа 29 и 19 показывают, в каком массовом отношении надо взять растворы с ω1(H2SO4) = 82% и ω2(Н2SО4) = 34%, соответственно. То есть для приготовления 48 г раствора серной кислоты с массовой долей ω(Н2SО4) = 63% необходимо смешать 29 г раствора с ω1(Н2SО4) = 82% и 19 г раствора с ω2(Н2SО4) = 34%.
2. Определим массу раствора серной кислоты с массовой долей ω(H2SO4) = 63%:
m63% р-ра = ρ63% р-ра ∙ V63% р-ра = 1,535 ∙ 70 = 107,45 г.
3. Определим массу и объем раствора с массовой долей ω1(H2SO4) = 82%, необходимого для приготовления искомого раствора.
Для приготовления 48 г 63%-го р-ра необходимо взять 29 г 82%-го р-ра;
для приготовления 107,45 г 63%-го р-ра –––––"–––– m г 82%-го р-ра;
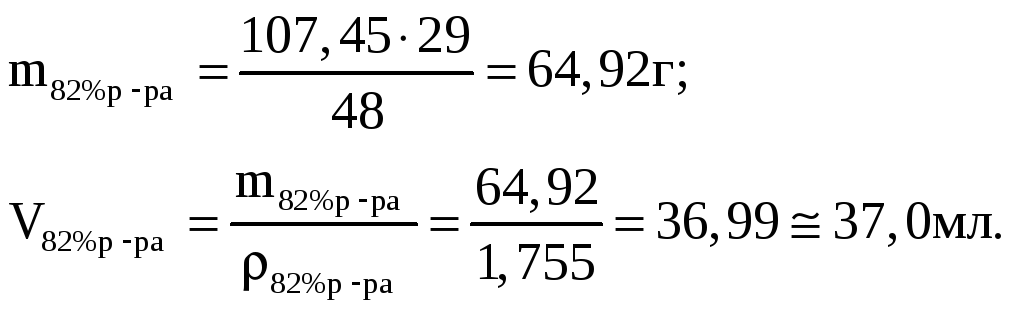
4. Определим массу и объем раствора с массовой долей ω2(H2SO4) = 34%, необходимого для приготовления искомого раствора:
для приготовления 48 г 63%-го р-ра необходимо взять 19 г 34%-го р-ра;
для приготовления 107,45 г 63%-го р-ра –––––"–––– m г 34%-го р-ра;
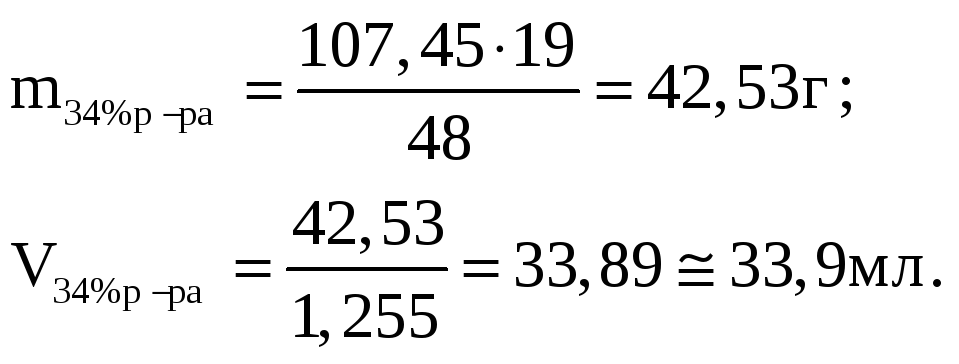
Таким образом, для приготовления 70 мл раствора с ω(H2SO4) = 63% нужно смешать 37,0 мл 82%-го и 33,9 мл 34%-го растворов.
Пример 6. Сколько граммов кристаллогидрата Cu(СН3СОО)2∙Н2О и раствора с массовой долей ω1(Cu(СН3СОО)2) = 3% нужно взять для приготовления 580 г раствора ацетата меди с массовой долей ω(Cu(СН3СОО)2) = 25%.
Решение. Сложность этого примера состоит в том, что кристаллогидрат содержит воду, которая добавляется при приготовлении раствора к воде, взятой в качестве растворителя. Имеется несколько способов решения. Приведем один из них.
1. Кристаллогидрат Cu(СН3СОО)2∙Н2О можно рассматривать как твердый водный раствор. Определим массовую долю ω2(Cu(СН3СОО)2) в кристаллогидрате:
Cu(CH3COO)2∙H2O Cu(CH3COO)2
М = 200 г/моль М = 182 г/моль
в 200 г Cu(CH3COO)2∙H2O содержится 182 г Cu(СH3СОО)2;
в 100 г Cu(CH3COO)2∙H2O –––––"–––– х г Cu(СH3СОО)2;
![]() г.
г.
Следовательно, кристаллогидрат Cu(СН3СОО)2∙Н2О представляет собой раствор с массовой долей ω2(Cu(СН3СОО)2) = 91%.
2. Теперь сформулируем исходное условие следующим образом: необходимо приготовить 580 г раствора ацетата меди с массовой долей ω(Cu(СН3СОО)2) = 25% из растворов с массовой долей ω2(Cu(СН3СОО)2) = 91% и массовой долей ω1(Cu(СН3СОО)2) = 3%. Найдем их массы, используя правило смешения.
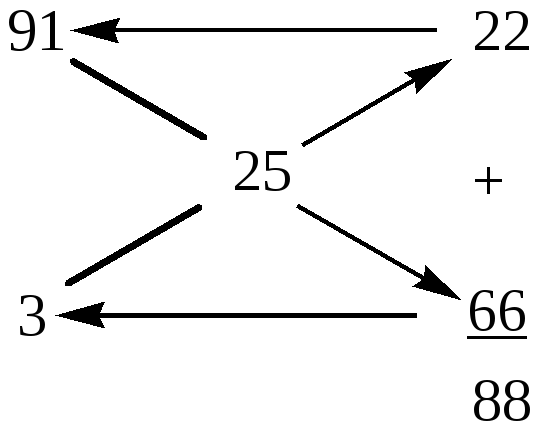
Из схемы видно, что для приготовления 88 г (22 + 66) раствора ацетата меди с массовой долей ω(Cu(СН3СОО)2) = 25% нужно в 66 г раствора с ω1(Cu(СН3СОО)2) = 3% растворить 22 г кристаллогидрата меди. Для приготовления 580 г 25%-го раствора массы смешиваемых компонентов определяются из пропорции:
для приготовления 88 г 25%-го р-ра Cu(СН3СОО)2 нужно взять 66 г 3%-го р-ра;
для приготовления 580 г 25%-го р-ра Сu(СН3СОО)2 –––– " –––– у1 г 3%-го р-ра;
![]() г р-ра
Cu(CH3COO)2
c ω1(Cu(СH3COO)2)
= 3%.
г р-ра
Cu(CH3COO)2
c ω1(Cu(СH3COO)2)
= 3%.
Аналогично найдем массу кристаллогидрата:
для приготовления 88 г 25% р-ра Cu(СН3СОО)2 нужно взять 22 г Cu(СН3СОО)2∙Н2О;
для приготовления 580 г 25% р-ра Сu(СН3СОО)2 –––– " –––– у2 г Сu(СН3СОО)2∙Н2О;
![]() г.
г.
Таким образом, для приготовления 580 г 25%-го раствора Cu(СН3СОО)2 необходимо взять 145 г кристаллогидрата Cu(СН3СОО)2∙Н2О и 435 г 3%-го раствора Cu(СН3СОО)2.
Пример 7. Определите коэффициент растворимости K (масса растворенного вещества m(В), приходящегося на 100 г растворителя, в граммах) и массовую долю растворенного вещества ω(В) (в %), если в 84,68 г насыщенного раствора содержится 14,56 г растворенного вещества.
Решение.
-
Определяем ω(В) (в %). Для этого воспользуемся формулой (7.1.2):
![]()
2. Определяем коэффициент растворимости К.
По условию масса раствора – 84,68 г, а масса растворенного вещества – 14,56 г.
Следовательно, масса растворителя равна: m(A) = 84,68 – 14,56 = 70,12 г.
На 70,12 г растворителя приходится 14,56 г растворенного вещества;
на 100 г растворителя –––– " –––– К г растворенного вещества;
![]() г, т.е. К = 20,8 г/100 г растворителя.
г, т.е. К = 20,8 г/100 г растворителя.
Пример 8. Масса раствора, насыщенного при 343 K, равна 401,11 г. Масса воды в этом растворе на 21,11 г больше массы соли. Сколько граммов соли выделится из этого раствора, если его охладить до 293 K? Какова массовая доля соли в растворе до и после охлаждения, если в 100 г воды при 293 K растворяется 65,5 г соли?
Решение. Массу соли принимаем за m1(В). Тогда масса воды равна:
m(Н2О) = m1(В) + 21,11, а их сумма m1(В) + (m1(В) + 21,11) = 401,11 г представляет собой массу исходного раствора. Решаем полученное уравнение относительно m1(В):
2·m1(В) = 401,11 – 21,11 = 380 г; m1(В) = 190 г, следовательно, в 401,11 г насыщенного при 343 K раствора содержится 190 г соли и 211,11 г воды. При охлаждении раствора до 293 K масса воды не изменится.
По условию в 100 г воды растворяется 65,5 г соли,
в 211,11 г воды –––– " –––– х г соли,
![]() соли.
соли.
Тогда при охлаждении из раствора выделится: 190,00 – 138,28 = 51,72 г соли. Массовую долю соли в растворе при 343 K можно найти по формуле (7.1.2):
![]() при 343 К.
при 343 К.
Масса раствора при понижении температуры до 293 K уменьшится на 51,72 г и будет равна: m2 р-ра = 401,11 – 51,72 = 349,39 г.
Чтобы найти массовую долю соли в растворе при 293 K, снова воспользуемся формулой (7.1.2):
![]() при 293 К.
при 293 К.
Пример 9. При выпаривании 1 кг раствора с массовой долей NaOH 16% удалено 100 г воды. Какова массовая доля (в %) NaOH в растворе после выпаривания?
Решение. В 1 кг раствора с массовой долей ω1(NaOH) = 16% содержится 160 г гидроксида натрия. После выпаривания 100 г воды из раствора его масса составит 900 г (m2 р-ра = 1000 – 100 = 900 г), а масса NaOH останется прежней, т.е. 160 г. Найдем концентрацию раствора после выпаривания воды:
![]()
Пример 10. При температуре 293 K и давлении P = 760 мм ртутного столба в 100 г воды растворяется 71 л аммиака. Определите моляльную концентрацию и массовую долю аммиака (в %) в растворе.
Решение.
1. Поскольку объем аммиака измерен при
Т = 293 K, необходимо привести
его к нормальным условиям, используя
соотношение
![]() :
:
![]()
2. Найдем число моль аммиака, занимающего объем 66,15 л. В соответствии с законом Авогадро:
1 моль NH3 занимает объем 22,4 л (н.у.),
n моль NH3 –––– " –––– 66,15 л,
![]()
3. Зная число моль аммиака, мы можем найти его массу: m(NH3) = n(NH3) ∙ M(NH3) = = 2,95 моль ∙ 17 г/моль = 50,2 г. Масса полученного по условию раствора аммиака составит mр-ра = m(Н2О) + m(NH3) = 100 + 50,2 = 150,2 г, масса растворителя (воды) равна m(Н2О) = 0,1 кг. Моляльную концентрацию и массовую долю раствора аммиака можно рассчитать с помощью формул (7.1.5) и (7.1.2), соответственно:
![]() моль/(кг Н2О);
моль/(кг Н2О);
![]()
Пример 11. Рассчитайте, какие
объемы концентрированной серной кислоты
с массовой долей ω(H2SO4) = 96%
и воды необходимо смешать, чтобы получить
0,5 л 20%-ной серной кислоты, если плотности
растворов H2SO4 равны:
![]() = 1,84 г/см3,
= 1,84 г/см3,
![]() =
= 1,14 г/см3.
=
= 1,14 г/см3.
Решение.
1. Рассчитаем массу 20%-го раствора H2SO4:
![]() г.
г.
2. Найдем массу безводной H2SO4 в этом растворе:
![]() г.
г.
3. Рассчитаем массу 96%-го раствора H2SO4, в котором содержится 114 г безводной серной кислоты:
![]() г.
г.
4. Найдем объем, занимаемый концентрированным раствором H2SO4 с массовой долей 96%:
![]() см3.
см3.
5. Рассчитаем массу воды, необходимой для разбавления 96%-го раствора H2SO4 до 20%-го раствора:
![]() г.
г.
6. Так как плотность воды 1 г/см3, то объем воды численно равен ее массе, т.е.
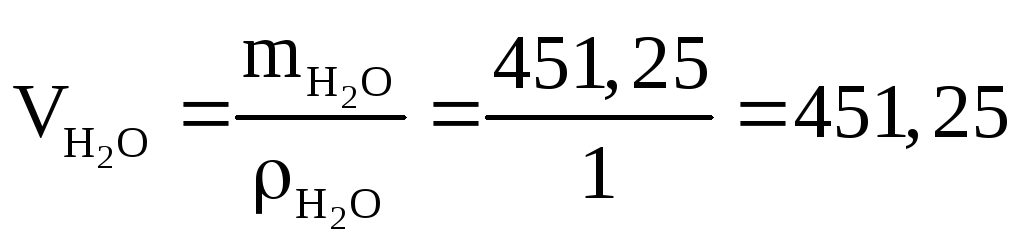 см3.
см3.
Таким образом, для приготовления 0,5 л 20%-го раствора H2SO4 необходимо смешать 64,54 см3 96%-го раствора H2SO4 и 451,25 см3 воды.
Примечание. Объем воды нельзя рассчитывать по разности объемов разбавленного и концентрированного растворов H2SO4. Так, 500 – 64,54 = 435,46 см3, однако это число не равно объему воды (451,25 см3), необходимому для разбавления концентрированного раствора H2SO4. Это несоответствие вызвано сжатием раствора при разбавлении концентрированной серной кислоты. Поэтому объем воды, необходимый для разбавления, определяют по разности масс разбавленного и концентрированного растворов, как это сделано в приведенном выше примере.
