
- •Часть 1
- •1. Техника безопасности работы в лаборатории
- •1.1. Порядок работы в химической лаборатории. Техника эксперимента
- •1.1.1. Меры предосторожности при работе с кислотами и щелочами
- •1.1.2. Правила безопасности при работе с пробирками
- •1.1.3. Оказание первой помощи при несчастных случаях
- •2. Классы химических соединений
- •2.1. Оксиды
- •2.2. Кислоты
- •2.3. Основания
- •2.4. Соли
- •Лабораторная работа № 1. Классы химических соединений
- •1. Основания
- •2. Кислоты
- •3. Соли
- •4. Оксиды
- •3. Теория электролитической диссоциации
- •3.1. Диссоциация кислот, оснований и солей
- •3.2. Ионные уравнения реакций
- •Лабораторная работа № 2. Электролитическая диссоциация
- •2. Реакции между растворами электролитов
- •3. Различие между ионами.
- •4. Номенклатура неорганических веществ
- •4.1. Бинарные (идо-) соединения
- •4.2. Псевдобинарные соединения
- •Лабораторная работа №3. Получение малорастворимых гидроксидов и сульфидов с помощью обменных реакций
- •5. Комплексные (координационные) соединения
- •5.1. Изомерия комплексных соединений
- •5.2. Равновесия в растворах комплексных соединений
- •5.3. Классификация комплексных соединений
- •5.4. Способы получения комплексных соединений
- •5.5. Номенклатура комплексных (ато-) соединений
- •Лабораторная работа № 4. Получение комплексных соединений
- •6. Получение гексацианоферратных комплексов железа (II) и железа (III).
- •6. Окислительно-восстановительные реакции
- •6.1. Подбор коэффициентов окислительно-восстановительных реакций
- •6.2. Метод электронного баланса
- •6.3. Метод полуреакций
- •6.4. Контрольные задания для самостоятельной подготовки
- •Лабораторная работа №5. Окислительно-восстановительные реакции в кислой среде
- •6.5. Влияние среды на характер протекания реакций
- •Лабораторная работа № 6. Окислительно-восстановительные реакции в щелочной среде
- •7. Растворы. Способы выражения концентрации
- •7.1. Важнейшие понятия и определения
- •7.2. Примеры решения типовых задач
- •7.3. Контрольные вопросы и задачи для самостоятельной подготовки по теме «Способы выражения концентрации» Вопросы для индивидуальной подготовки
- •Лабораторная работа № 7. Способы выражения концентрации раствора. Приготовление раствора заданной концентрации
- •Приложение
- •Плотность водных растворов Na2co3 при 20оС, г/см3
- •Плотность водных растворов Al2(so4)3 при 20оС, г/см3
- •Плотность водных растворов Al(no3)3 при 20оС, г/см3
- •Плотность водных растворов MgSo4 при 20оС, г/см3
- •Плотность водных растворов CaCl2 при 20оС, г/см3
- •Плотность водных растворов FeCl3 при 20оС, г/см3
- •Плотность водных растворов MnCl2 при 20оС, г/см3
- •Плотность водных растворов MnSo4 при 20оС, г/см3
- •Плотность водных растворов NaCl при 20оС, г/см3
- •Список литературы
6. Окислительно-восстановительные реакции
Степень окисления – это условный заряд атома в соединении (кратный заряду электрона), вычисленный исходя из предположения, что все связи в нем ионные. Понятно, что эта величина лишь формально выражает заряд атома, т.к. далеко не все вещества образованы посредством ионных связей. Веществ с идеальной ионной связью, т.е. связью, при образовании которой происходит полная передача электронов от одного атома к другому, практически не существует. В связи с этим заряд атома в соединении может принимать любые значения: целочисленные и дробные, положительные и отрицательные. Несмотря на то, что понятие степени окисления является сугубо формальным, оно широко используется для классификации соединений, характеристики их химической природы и свойств; при составлении уравнений окислительно-восстановительных реакций; для предсказания направления течения и продуктов химических реакций и т.д.
Степень окисления элементов в большинстве соединений можно оценить при помощи арифметического расчета, учитывая то, что некоторые элементы в своих соединениях проявляют постоянную степень окисления.
При этом используются следующие общие правила:
а) в молекуле алгебраическая сумма степеней окисления элементов с учетом числа их атомов равна нулю, а в сложном ионе – заряду иона;
б) элемент в простом веществе имеет нулевую степень окисления;
в) металлы в большинстве соединений имеют положительную степень окисления;
г) щелочные металлы (Li, Na, K, Rb, Cs, Fr) в своих соединениях имеют постоянную степень окисления +1;
д) щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra), а также цинк и кадмий в своих соединениях имеют постоянную степень окисления +2;
е) бор и алюминий в своих соединениях имеют постоянную степень окисления +3;
ж) степень окисления водорода в большинстве соединений равна +1, за исключением гидридов – соединений водорода с менее электроотрицательными элементами, где она равна –1 (например, NaH, СаН2, В2Н6, GeH4);
з) степень окисления кислорода принимается равной –2 в большинстве соединений, кроме фторида кислорода OF2, пероксидов (например, Na2O2), надпероксидов (например, КО2), озонидов (например, КО3),где она равна +2, –l, –1/2 и –1/3, соответственно, а также некоторых других редко встречающихся соединений;
и) фтор во всех своих соединениях имеет постоянную степень окисления –1;
к) положительная максимальная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе (исключение составляют металлы подгруппы меди, кислород, фтор, металлы семейства железа и некоторые другие элементы VIII группы).
Определение степеней окисления элементов в различных соединениях
Пример 1. Степень окисления хрома в дихромате калия K2Cr2O7 определяем с учетом того, что степень окисления калия равна +1, а кислорода –2. Обозначим степень окисления хрома через х. Найдем сумму положительных и отрицательных зарядов всех атомов в данной молекуле (она должна быть равна нулю, так как все молекулы электронейтральны).
K2Cr2O7 2(+1) + 2x + 7(–2) = 0, откуда x = +6.
Пример 2. Степень окисления фосфора в молекуле Н3РО4 находим исходя из того, что степени окисления водорода и кислорода нам известны и равны, соответственно, +1 и –2. Обозначим степень окисления фосфора через х. Составим баланс зарядов всех атомов.
Н3РО4 3(+1) + 1x + 4(–2) = 0, откуда х = +5.
Пример 3. Обозначим степень окисления азота в ионе аммония NH4+ через х. Для нахождения х найдем сумму степеней окисления всех атомов в ионе аммония, которая должна равняться заряду этого иона. При этом предполагается, что степень окисления водорода известна и равна (+1).
NH4+ 1x + 4(+1) = +1, откуда x = –3.
Пример 4. Найдем степень окисления серы в сульфит-ионе SO32-, при условии, что степень окисления кислорода равна –2. Обозначим искомую величину через х. Тогда сумму положительных и отрицательных зарядов всех атомов должна равняться заряду данного иона:
SO32- 1x + 3(–2) = –2, откуда x = + 4.
Для определения степени окисления элемента в соединении, содержащем два или более атомов одного и того же элемента, необходимо знать строение данного соединения. Так, экспериментально установлено, что в СrО5 четыре из пяти атомов кислорода образуют две пероксидные группировки –О–О–, следовательно, степень окисления каждого из четырех атомов О равна –1, а у пятого –2. Тогда степень окисления хрома определяется, как х + 4(–1) + (–2) = 0, х = +6. При отсутствии подобных доказательств степени окисления у всех атомов элемента оставляются одинаковыми. Например, не имея дополнительной информации о строении тетратионата натрия Na2S4O6, можно считать, что степень окисления серы равна +2,5, однако, рассмотрев строение молекулы, можно установить, что два атома серы имеют степень окисления –2, а два других – +6:
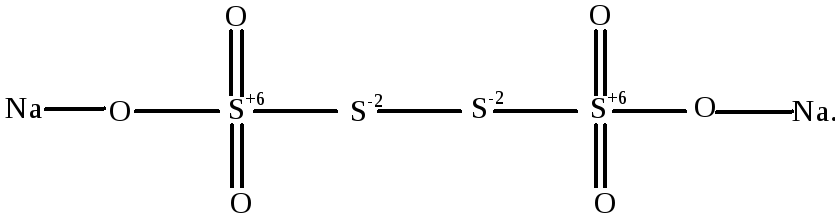
Наиболее важное применение степеней окисления элементов – это их использование при подборе коэффициентов в окислительно-восстановительных реакциях. Отсюда само название – степень окисления.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Рассмотрение окислительно-восстановительных реакций базируется на следующих понятиях и положениях.
1. Окислением называется процесс отдачи атомом, молекулой или ионом электронов. Например:
Al –
![]()
Al3+; Fe2+
–
Al3+; Fe2+
–
![]()
Fe3+; H2
–
Fe3+; H2
–
![]()
2H+.
2H+.
При окислении степень окисления атомов повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. Например:
S +
![]()
S2-; Cl2
+
S2-; Cl2
+
![]()
2Cl-; Fe3+
+
2Cl-; Fe3+
+
![]()
Fe2+.
Fe2+.
При восстановлении степень окисления атомов понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Важнейшими восстановителями являются: металлы, водород, уголь, CO, H2S, SO2, H2SO3, HI, HBr, HCl, SnCl2, FeSO4, MnSO4, CrCl2, NH3, гидразин N2H4, H3PO3, альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза, электрический ток на катоде. Обычно восстановители содержат элемент с минимальным значением степени окисления. Восстановители способны только к отдаче электронов.
4. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Важнейшими окислителями являются: галогены, KMnO4, K2MnO4, K2Cr2O7, O2, O3, H2O2, H2SO4 (конц.), HNO3, Ag2O, PbO2, (NH4)2S2O8, ионы Au3+, Ag+, гипохлориты, хлораты, «царская водка», электрический ток на аноде. Обычно окислители содержат элемент с максимальным значением степени окисления. Окислители способны только к принятию электронов.
5. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель –
![]() Окислитель;
Окислитель;
Окислитель +
![]() Восстановитель.
Восстановитель.
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом независимо от того, переходят ли электроны от одного атома к другому полностью или лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
