
- •Часть 1
- •1. Техника безопасности работы в лаборатории
- •1.1. Порядок работы в химической лаборатории. Техника эксперимента
- •1.1.1. Меры предосторожности при работе с кислотами и щелочами
- •1.1.2. Правила безопасности при работе с пробирками
- •1.1.3. Оказание первой помощи при несчастных случаях
- •2. Классы химических соединений
- •2.1. Оксиды
- •2.2. Кислоты
- •2.3. Основания
- •2.4. Соли
- •Лабораторная работа № 1. Классы химических соединений
- •1. Основания
- •2. Кислоты
- •3. Соли
- •4. Оксиды
- •3. Теория электролитической диссоциации
- •3.1. Диссоциация кислот, оснований и солей
- •3.2. Ионные уравнения реакций
- •Лабораторная работа № 2. Электролитическая диссоциация
- •2. Реакции между растворами электролитов
- •3. Различие между ионами.
- •4. Номенклатура неорганических веществ
- •4.1. Бинарные (идо-) соединения
- •4.2. Псевдобинарные соединения
- •Лабораторная работа №3. Получение малорастворимых гидроксидов и сульфидов с помощью обменных реакций
- •5. Комплексные (координационные) соединения
- •5.1. Изомерия комплексных соединений
- •5.2. Равновесия в растворах комплексных соединений
- •5.3. Классификация комплексных соединений
- •5.4. Способы получения комплексных соединений
- •5.5. Номенклатура комплексных (ато-) соединений
- •Лабораторная работа № 4. Получение комплексных соединений
- •6. Получение гексацианоферратных комплексов железа (II) и железа (III).
- •6. Окислительно-восстановительные реакции
- •6.1. Подбор коэффициентов окислительно-восстановительных реакций
- •6.2. Метод электронного баланса
- •6.3. Метод полуреакций
- •6.4. Контрольные задания для самостоятельной подготовки
- •Лабораторная работа №5. Окислительно-восстановительные реакции в кислой среде
- •6.5. Влияние среды на характер протекания реакций
- •Лабораторная работа № 6. Окислительно-восстановительные реакции в щелочной среде
- •7. Растворы. Способы выражения концентрации
- •7.1. Важнейшие понятия и определения
- •7.2. Примеры решения типовых задач
- •7.3. Контрольные вопросы и задачи для самостоятельной подготовки по теме «Способы выражения концентрации» Вопросы для индивидуальной подготовки
- •Лабораторная работа № 7. Способы выражения концентрации раствора. Приготовление раствора заданной концентрации
- •Приложение
- •Плотность водных растворов Na2co3 при 20оС, г/см3
- •Плотность водных растворов Al2(so4)3 при 20оС, г/см3
- •Плотность водных растворов Al(no3)3 при 20оС, г/см3
- •Плотность водных растворов MgSo4 при 20оС, г/см3
- •Плотность водных растворов CaCl2 при 20оС, г/см3
- •Плотность водных растворов FeCl3 при 20оС, г/см3
- •Плотность водных растворов MnCl2 при 20оС, г/см3
- •Плотность водных растворов MnSo4 при 20оС, г/см3
- •Плотность водных растворов NaCl при 20оС, г/см3
- •Список литературы
7. Растворы. Способы выражения концентрации
7.1. Важнейшие понятия и определения
Раствор – это сложная однородная (гомогенная) система, состоящая из двух и более компонентов, относительные количества которых могут меняться в широких пределах без нарушения однородности. В этом определении под системой подразумевается совокупность частиц, находящихся в определенном взаимодействии и занимающих ограниченный объем, а компонентами раствора называют его составные части, которые могут быть выделены в свободном состоянии.
Растворы могут быть твердыми, жидкими и газообразными. Для химии наибольшее значение имеют жидкие растворы. Они обладают благоприятными условиями как для перемещения молекул и ионов, так и для тесного их сближения, необходимого для химического взаимодействия. Большинство промышленных химических процессов и лабораторных синтезов протекают в водных и неводных растворах.
Компоненты жидкого раствора условно подразделяют на растворитель и растворенное вещество (одно или несколько). При растворении твердых веществ или газов в жидкости за растворитель принимается жидкость. При образовании раствора из двух жидкостей за растворитель принимают ту из них, которой взято больше.
Масса раствора складывается из суммы масс растворителя (А) и растворенного вещества (В):
mр-ра = m(A) + m(B). (7.1.1)
Если растворенное вещество в растворе раздроблено до молекулярного или атомного уровня (диаметр частиц вещества ≤ 10-9 м), то такие растворы относятся к истинным (молекулярным) растворам. Они устойчивы, не расслаиваются при длительном стоянии, прозрачны и легко проходят через фильтр.
Основным признаком, характеризующим раствор, является его однородность. По этому признаку растворы больше напоминают химические соединения и отличаются от механических смесей. С другой стороны, растворы не имеют строго определенного состава. В этом их существенное отличие от химических соединений.
Природа растворов сложна и многообразна, а теория растворов и на сегодняшний день является одной из наиболее сложных областей химии. В учении о растворах еще много проблем, хотя целый ряд важных и сложных вопросов уже выяснен. Ранее существовали две теории растворов: физическая и химическая. Согласно первой растворы рассматривали как механические смеси, согласно второй – как нестойкие химические соединения частиц растворенного вещества и растворителя. Современная теория растворов является синтезом физической и химической теорий. Она рассматривает жидкие растворы как физико-химические системы, занимающие промежуточное положение между химическими соединениями и механическими смесями, а процесс растворения – как сложное физико-химическое явление, сопровождающееся поглощением или выделением тепловой энергии, изменением объема и другими эффектами.
При растворении наблюдается изменение свойств как растворенного вещества, так и растворителя. Например, сухая поваренная соль не проводит электрический ток, дистиллированная вода тоже не проводит ток, а водный раствор поваренной соли электропроводен. Изменение свойств растворителя и растворенного вещества связано с возникновением между компонентами раствора различного рода межмолекулярных взаимодействий (от очень слабых, типа Ван-дер-Ваальсовых, до сильных – химических) и появлением продуктов взаимодействия – сольватов.
Сольваты (гидраты, если растворитель – вода) представляют собой в большинстве случаев непрочные соединения, легко разлагающиеся при выделении их в свободном состоянии. Но иногда сольваты представляют собой прочные соединения, которые можно легко выделить из раствора путем кристаллизации. Кристаллические вещества, содержащие молекулы растворителя, называются кристаллосольватами (кристаллогидратами, если растворитель – вода). Примеры кристаллогидратов: FeSO4∙7H2O – железный купорос; CuSO4∙5H2O – медный купорос; Na2CO3∙10H2O – сода и т.д. Вода, входящая в состав кристаллогидратов, называется кристаллизационной водой.
Процесс растворения, т.е. получения истинного раствора, является процессом самопроизвольным. Например, для получения раствора сахара в воде достаточно бросить кристаллик сахара в воду, т.е. достаточно соприкосновения, контакта между растворителем и растворяемым веществом. В результате взаимодействия молекул воды с молекулами сахара последние отрываются от поверхности кристалла и, благодаря диффузии, равномерно распределяются в объеме раствора. Однако процесс растворения не является односторонним. Молекулы растворяемого вещества не только переходят с поверхности кристалла в раствор, но и выделяются из раствора на поверхность этого же кристалла. Таким образом, одновременно идут два процесса: растворение и кристаллизация. После установления равновесия содержание растворяемого вещества в растворе остается неизменным, если не изменяются условия, при которых находится раствор – например, температура. Такое состояние раствора называется состоянием насыщения, а раствор – насыщенным. Состояние насыщения раствора соответствует максимальной растворимости вещества. В ненасыщенном растворе содержится меньше растворенного вещества, а в пересыщенном – больше, чем в насыщенном при одинаковых условиях. Растворимость зависит от природы растворенного вещества и растворителя, от температуры и давления. Изменение внешних условий влияет на растворимость вещества в соответствии с принципом Ле Шателье.
Основной характеристикой раствора является его состав, который определяет раствор качественно (из каких компонентов состоит раствор) и количественно (выражается концентрацией). Течение химических процессов зависит, прежде всего, от концентрации раствора.
Концентрация раствора показывает содержание растворенного вещества в единице массы раствора или растворителя, или в единице объема раствора. Для приблизительной оценки концентрации растворов часто пользуются терминами «концентрированный» и «разбавленный» раствор. Граница между концентрированным и разбавленным растворами условна. К концентрированным растворам относятся растворы, в которых количество растворенного вещества сравнимо с количеством растворителя. К разбавленным относятся растворы, содержащие очень малое количество растворенного вещества по сравнению с количеством растворителя.
Для точного выражения концентрации существует много способов. Чтобы овладеть умением правильно решать поставленные задачи, необходимо твердо усвоить определение каждого из них. Рассмотрим способы выражения концентрации, применяемые наиболее часто.
Для различных практических расчетов в химии широко используются такие способы выражения концентрации раствора, как массовая и молярная (мольная) доли.
Массовая доля ω(В) растворенного вещества B есть отношение массы растворенного вещества к общей массе раствора, выраженное в процентах. Массовая доля растворенного вещества показывает, сколько грамм растворенного вещества содержится в 100 г раствора.
![]() (7.1.2)
(7.1.2)
Можно также выражать массовую долю растворенного вещества ω(В) в долях единицы.
Пример. Общая масса раствора m = 6 кг. Масса растворенного вещества m(В) равна 1,5 кг.
Тогда:
![]()
Определение молярной доли требует ясного представления о количестве вещества. Количество вещества n(X) характеризует размер порции вещества численностью содержащихся в ней частиц Х. В Международной системе единиц (СИ) за единицу количества вещества принят моль.
Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов или др.), сколько содержится атомов в 0,012 кг изотопа 12С.
Примеры указания количества вещества:
n(Ca2+) = 2 моль;
n(K2Cr2O7) = 6 моль;
n(CH4) = 25 кмоль;
n(H в CH4) = 100 кмоль.
Молярная масса M(Х) вещества, состоящего из частиц Х, равна отношению массы m(X) порции вещества к количеству вещества n(X) в этой порции:
![]() (7.1.3)
(7.1.3)
Единицей СИ молярной массы является килограмм на моль (кг/моль). Часто используемая единица – грамм на моль (г/моль). Примеры:
M(Ca) = 40,08 г/моль;
M(H) = 1,0079 г/моль;
M(HCl) = 36,4606 г/моль.
Число частиц в моль любого вещества одно и то же. Оно равно 6,02∙1023 и называется NA (число Авогадро).
Молярная доля N(В) – есть отношение числа моль данного вещества n(В) к общему числу моль всех веществ, содержащихся в растворе
![]() (7.1.4)
(7.1.4)
где
![]() – количество всех веществ, содержащихся
в растворе. Концентрация, выраженная
в массовых и молярных долях, не зависит
от температуры, поэтому используется
в физико-химических исследованиях.
– количество всех веществ, содержащихся
в растворе. Концентрация, выраженная
в массовых и молярных долях, не зависит
от температуры, поэтому используется
в физико-химических исследованиях.
Массовая и молярная доли компонентов веществ, смесей – относительные величины, поэтому их единицами являются доли единицы, проценты (%), промилле (‰) и миллионные доли (00/00).
Моляльная концентрация (моляльность) Сm(В) (или b(B)) показывает, сколько моль растворенного вещества B, содержащегося в растворе, приходится на 1000 г или 1 кг растворителя. Она может быть определена отношением количества растворенного вещества (В) к массе растворителя (А), выраженной в килограммах:
![]() (7.1.5)
(7.1.5)
где M(В) – молярная масса вещества В.
Единицей СИ моляльности является моль на килограмм (моль/кг).
Например, запись Cm(H2SO4) = 3,0 моль/(кг H2O) означает, что в данном растворе на каждый килограмм воды как растворителя приходится 3,0 моль серной кислоты.
b(нафталин/бензол) = 0,05 моль/кг – это значит, что в данном растворе в 1 кг бензола растворено 0,05 моль нафталина.
Моляльная концентрация не изменяется при изменении температуры и, так же как массовая и молярная доли, используется в физико-химических исследованиях.
В аналитической практике при расчетах часто используют молярную концентрацию вещества и молярную концентрацию эквивалента вещества.
Молярная концентрация C(В) показывает, сколько моль растворенного вещества B содержится в 1000 мл или 1 л раствора. Она может быть определена отношением числа моль растворенного вещества B к объему раствора V, выраженному в литрах:
![]() (7.1.6)
(7.1.6)
Единицей СИ молярной концентрации является моль на кубический метр (моль/м3). Обычно применяют кратные единицы: моль на литр (моль/л) или моль на кубический дециметр (моль/дм3).
Так, например, если в 1 л раствора содержится 20 г NaOH, то
![]()
при содержании в 1 л раствора 40 г NaOH – концентрация раствора C(NaOH) = 1 моль/л; в случае содержания в 1 л раствора 196 г H2SO4 получим C(H2SO4) = 2 моль/л и т.д.
Вместо обозначений моль/л возможно обозначение М – молярный. Например, 1 М КОН – одномолярный раствор КОН; 0,01 М – сантимолярный; 0,001 М – миллимолярный и т.д.
Применение молярного способа выражения концентраций удобно тем, что равные объемы растворов при одинаковой концентрации содержат одинаковое число молекул растворенных веществ.
В некоторых реакциях, в частности, нейтрализации, окисления – восстановления и ионообмена, принимает участие не целая частица Х, а лишь ее часть, называемая эквивалентом. Эквивалент есть 1/z* часть частицы. При z*=1 эквивалент идентичен самой частице. Число z* называют «числом эквивалентности». Для кислот оснований и солей z* равно, соответственно, основности, кислотности или количеству элементарных зарядов анионов или катионов. Если частица Х является окислителем или восстановителем, то z* равно количеству присоединяемых или отдаваемых электронов.
Количество вещества эквивалента n(1/z* X) равно произведению числа эквивалентности z* на количество вещества частиц Х:
![]() (7.1.7)
(7.1.7)
Единицей СИ количества вещества эквивалента является моль.
Например:
n(1/2 Ca2+) = 4 ммоль;
n(1/6 K2Cr2O7) = 12 моль.
Молярная масса эквивалента
![]() есть отношение молярной массы частиц
Х M(X) к числу
эквивалентности z*:
есть отношение молярной массы частиц
Х M(X) к числу
эквивалентности z*:
![]() (7.1.8)
(7.1.8)
Единица СИ молярной массы эквивалента – килограмм на моль (кг/моль). Обычно применяемая единица – грамм на моль (г/моль).
Например, молярная масса эквивалента щавелевой кислоты H2C2O4 равна:
![]()
Молярная концентрация эквивалента Сэк(В) показывает, сколько моль-эквивалентов растворенного вещества B содержится в 1000 мл или 1 л раствора. Из определения следует соотношение, аналогичное формуле (7.1.6):
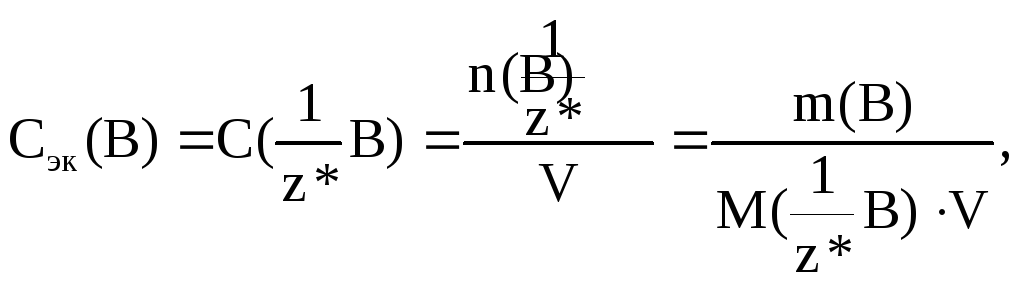 (7.1.9)
(7.1.9)
где V – объем раствора, л;
![]() –
молярная масса эквивалента вещества
B, г/моль.
–
молярная масса эквивалента вещества
B, г/моль.
Так как в одной ФЕ (формульной единице) вещества B может содержаться z*(B) эквивалентов этого вещества, то:
nэк(B) = z*(B) ∙ n(B),
где nэк(В) – это число моль-эквивалентов вещества B, n(В) – число моль вещества B, z*(B) – число эквивалентности растворенного вещества В.
Тогда из приведенных выше определений для молярной концентрации вещества B и молярной концентрации эквивалента вещества B следует, что молярная концентрация эквивалента растворенного вещества в z* раз больше его молярной концентрации:
Сэк(В) = z*(В) ∙ С(В).
Но так как значение числа эквивалентности z*(B) определяют по химической реакции, в которой участвует вещество B, то молярную концентрацию эквивалента данного вещества нужно рассматривать применительно к конкретной реакции.
Для сокращенного обозначения молярной концентрации эквивалента вещества B используется символ Н (моль/л) – нормальный.
Например, молярная концентрация эквивалента водного раствора KMnO4 равна: Cэк(KMnO4, z* = 5) = С(1/5KMnO4) = 0,01 моль/л, где z* – число эквивалентности КМnО4. Другой вариант записи: 0,01 Н раствор КМnО4.
При исследовании химических реакций в растворе удобно пользоваться этим видом концентраций, поскольку произведение молярной концентрации эквивалента вещества B на объем раствора V(B) равно количеству эквивалента этого вещества. Поэтому для реакции, в которой в соответствии с законом эквивалентов участвуют равные количества эквивалентов вещества A и B справедливы соотношения:
Сэк(А) ∙ V(А) = Сэк(В) ∙ V(B), (7.1.10)
![]() (7.1.11)
(7.1.11)
то есть, если известны объемы растворов реагирующих веществ, можно определить молярную концентрацию эквивалента одного из растворов (Сэк(А) или Сэк(В)) по молярной концентрации эквивалента другого раствора или, если известны концентрации, можно найти один из неизвестных объемов (V(A) или V(B)).
Например, требуется определить объем 0,64 Н раствора Н2О2, который необходим для реакции в кислой среде с KI, содержащимся в 250 мл 0,14 Н раствора:
![]()
В лабораторной практике содержание вещества в одном растворе определяют путем постепенного добавления к нему другого раствора (рабочего) до момента прекращения реакции (метод титрования). Концентрацию рабочего раствора удобно выражать через титр.
Титр раствора T(В) вещества B показывает массу растворенного вещества (г), содержащегося в 1 мл раствора:
![]() (7.1.12)
(7.1.12)
где m(B) – масса растворенного вещества B (в г), V – объем раствора (в мл).
Согласно определению молярная концентрация, титр и молярная концентрация эквивалента вещества относятся к числу объемных концентраций (они выражают содержание вещества в единице объема раствора). При изменении температуры изменяется объем раствора, и перечисленные концентрации не сохраняют постоянства. Лишены этого недостатка массовые способы выражения концентраций – моляльная концентрация, массовая доля, молярная доля и т.д.
Растворимостью называют способность одного вещества растворяться в другом с образованием насыщенного раствора. Чаще всего растворимость выражают числом грамм растворенного вещества на 100 г или на 100 мл растворителя или раствора. Вообще растворимость веществ определяется концентрацией насыщенного при данной температуре раствора. При этом концентрация может быть выражена в любых единицах. Растворимость газов зависит и от давления. Эта зависимость выражается законом Генри: масса газа, растворяющегося при данной температуре в жидкости данного объема, прямо пропорциональна давлению газа.
По растворимости при T = const различают:
– хорошо растворимые вещества (образуют насыщенные растворы с молярной концентрацией > 0,1 М);
– малорастворимые вещества (образуют насыщенные растворы с молярной концентрацией 0,1 – 0,001 М);
– практически нерастворимые вещества (образуют насыщенные растворы с молярной концентрацией < 0,001 М).
Если принять, что для некоторого твердого вещества растворимость с ростом температуры увеличивается, то после приготовления горячего (почти насыщенного) раствора при охлаждении можно получить холодный насыщенный раствор. Образование последнего будет сопровождаться появлением первых кристаллов вещества, а при интенсивном перемешивании – осадка (массовая кристаллизация).
Растворение вещества, содержащего растворимые примеси, в горячей воде, а затем осаждение его из раствора при достаточном охлаждении – это способ очистки вещества от растворимых примесей, называемый перекристаллизацией. Примеси при этом, как правило, остаются в растворе, т.к. присутствуют там в малых количествах и при охлаждении не могут образовать своего насыщенного раствора. Некоторая часть очищаемого вещества также останется в холодном насыщенном растворе (такой раствор принято называть маточным). Чем больше уменьшается растворимость вещества при охлаждении раствора, тем выше будет выход перекристаллизированного вещества.
Часто бывает необходимо сделать перерасчет одного вида концентрации раствора в другой. Это возможно, т.к. масса растворенного вещества есть величина постоянная для одного и того же раствора. При расчетах, связанных с переходом от массовых способов выражения концентрации к объемным и обратно, необходимо знать плотности соответствующих растворов.
Плотность раствора представляет собой массу единицы объема раствора. Обозначается буквой ρ, выражается в кг/м3, г/см3, кг/дм3.
В повседневной практике обычно пользуются относительной плотностью, т.е. отношением плотности данного раствора к плотности дистиллированной воды при температуре 4°C (ρ(Н2О) = 1 г/мл). Плотность растворов определяют ареометрами или пикнометрами. Зная ρ, можно найти массовую долю вещества (в %) с помощью таблиц, отражающих зависимость плотности раствора от концентрации. Исходя из массовой доли, можно рассчитать молярную концентрацию и молярную концентрацию эквивалента растворенного вещества. Однако при использовании справочных таблиц часто приходится обращаться к методу интерполяции.
Интерполяция – это нахождение искомой величины в предположении линейного характера зависимости функции внутри выбранного интервала зависимости. Действительно, в любой, даже в самой подробной таблице значения данной функции могут приводиться только через определенные интервалы параметра.
