
- •Часть 1
- •1. Техника безопасности работы в лаборатории
- •1.1. Порядок работы в химической лаборатории. Техника эксперимента
- •1.1.1. Меры предосторожности при работе с кислотами и щелочами
- •1.1.2. Правила безопасности при работе с пробирками
- •1.1.3. Оказание первой помощи при несчастных случаях
- •2. Классы химических соединений
- •2.1. Оксиды
- •2.2. Кислоты
- •2.3. Основания
- •2.4. Соли
- •Лабораторная работа № 1. Классы химических соединений
- •1. Основания
- •2. Кислоты
- •3. Соли
- •4. Оксиды
- •3. Теория электролитической диссоциации
- •3.1. Диссоциация кислот, оснований и солей
- •3.2. Ионные уравнения реакций
- •Лабораторная работа № 2. Электролитическая диссоциация
- •2. Реакции между растворами электролитов
- •3. Различие между ионами.
- •4. Номенклатура неорганических веществ
- •4.1. Бинарные (идо-) соединения
- •4.2. Псевдобинарные соединения
- •Лабораторная работа №3. Получение малорастворимых гидроксидов и сульфидов с помощью обменных реакций
- •5. Комплексные (координационные) соединения
- •5.1. Изомерия комплексных соединений
- •5.2. Равновесия в растворах комплексных соединений
- •5.3. Классификация комплексных соединений
- •5.4. Способы получения комплексных соединений
- •5.5. Номенклатура комплексных (ато-) соединений
- •Лабораторная работа № 4. Получение комплексных соединений
- •6. Получение гексацианоферратных комплексов железа (II) и железа (III).
- •6. Окислительно-восстановительные реакции
- •6.1. Подбор коэффициентов окислительно-восстановительных реакций
- •6.2. Метод электронного баланса
- •6.3. Метод полуреакций
- •6.4. Контрольные задания для самостоятельной подготовки
- •Лабораторная работа №5. Окислительно-восстановительные реакции в кислой среде
- •6.5. Влияние среды на характер протекания реакций
- •Лабораторная работа № 6. Окислительно-восстановительные реакции в щелочной среде
- •7. Растворы. Способы выражения концентрации
- •7.1. Важнейшие понятия и определения
- •7.2. Примеры решения типовых задач
- •7.3. Контрольные вопросы и задачи для самостоятельной подготовки по теме «Способы выражения концентрации» Вопросы для индивидуальной подготовки
- •Лабораторная работа № 7. Способы выражения концентрации раствора. Приготовление раствора заданной концентрации
- •Приложение
- •Плотность водных растворов Na2co3 при 20оС, г/см3
- •Плотность водных растворов Al2(so4)3 при 20оС, г/см3
- •Плотность водных растворов Al(no3)3 при 20оС, г/см3
- •Плотность водных растворов MgSo4 при 20оС, г/см3
- •Плотность водных растворов CaCl2 при 20оС, г/см3
- •Плотность водных растворов FeCl3 при 20оС, г/см3
- •Плотность водных растворов MnCl2 при 20оС, г/см3
- •Плотность водных растворов MnSo4 при 20оС, г/см3
- •Плотность водных растворов NaCl при 20оС, г/см3
- •Список литературы
6. Получение гексацианоферратных комплексов железа (II) и железа (III).
а) К 3 – 4 каплям раствора соли железа (II) (например, FeSO4) прилейте столько же капель раствора гексацианоферрата (III) калия K3[Fe(CN)6] (красная кровяная соль). Наблюдайте образование синего осадка турнбулевой сини:
Fe2+ + K+ + [Fe(CN)6]3- KFe[Fe(CN)6].
б) К 3 – 4 каплям раствора соли железа (III) (например, FeCl3) прибавьте 2 – 3 капли раствора гексацианоферрата (II) калия K4[Fe(CN)6] (желтая кровяная соль). Выпадает темно-синий осадок берлинской лазури:
Fe3+ + K+ + [Fe(CN)6]4- ® KFe[Fe(CN)6]¯.
В каждом случае назовите полученные осадки, найдите внешнюю и внутреннюю сферы комплексного соединения и определите координационное число центрального атома.
7. Получение нитритного комплекса кобальта (III). Нитрит калия KNO2, прибавленный в избытке к раствору соли кобальта (II) (например, CoCl2), подкисленному уксусной кислотой, образует желтый кристаллический осадок комплексной соли K3[Co(NO2)6]:
Co2+ + 7NO2- + 3K+ + 2CH3COOH K3[Co(NO2)6] + NO↑ + 2CH3COO- + H2O.
Напишите молекулярное уравнение этой реакции, назовите образовавшийся осадок, найдите внешнюю и внутреннюю сферы комплексного соединения и определите координационное число центрального атома.
8. Получение тиоцианатного комплекса кобальта (II). К 2 каплям раствора соли кобальта (II) (например, CoCl2) прибавьте 8 капель насыщенного раствора тиоцианата аммония NH4SCN или тиоцианата калия KSCN (еще лучше прибавить немного твердой соли) и 5 – 6 капель амилового спирта. Взболтайте смесь. Наблюдайте окрашивание слоя амилового спирта в синий цвет (комплексное соединение лучше растворимо в амиловом спирте, чем в воде):
[Co(H2O)6]2+ + 4SCN- ® 6H2O + [Co(SCN)4]2-.
Напишите молекулярное уравнение этой реакции, назовите образовавшееся комплексное соединение, найдите его внешнюю и внутреннюю сферу и определите координационное число центрального атома.
9. Получение внутрикомплексной соли никеля (II). В пробирке смешайте по капле растворов соли никеля (II) (например, NiSO4), диметилглиоксима (реактив Чугаева) и разбавленного раствора аммиака. Образуется характерный красный осадок внутрикомплексной соли. Слишком кислая и слишком щелочная среда мешают реакции. Можно вести осаждение в присутствии ацетатной буферной смеси (смесь CH3COOH с избытком CH3COONa):
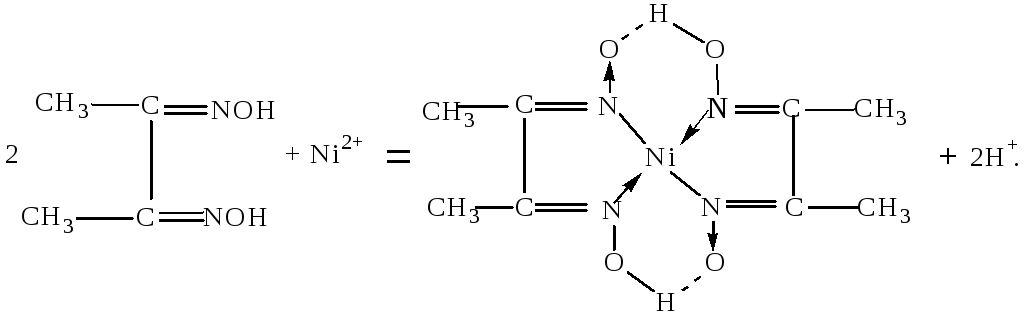
Напишите молекулярное уравнение этой реакции и определите координационное число центрального атома.
10. Получение аммиачного и тиосульфатного комплексов серебра (I). К 2 – 3 каплям раствора нитрата серебра (I) AgNO3 добавьте столько же капель раствора хлорида натрия NaCl (или хлорида калия KCl). Наблюдайте образование белого творожистого осадка AgCl:
Ag+ + Cl- AgCl.
Осадок хлорида серебра (I) разделите на две части – в две пробирки. В одну из пробирок добавьте концентрированный раствор тиосульфата натрия Na2S2O3, в другую – концентрированный раствор аммиака NH3·H2O. В каждом случае происходит растворение осадка AgCl:
AgCl + 2S2O32- [Ag(S2O3)2]3- + Cl-;
AgCl + 2NH3·H2O [Ag(NH3)2]+ + Cl- + 2H2O.
Напишите молекулярные уравнения реакций, назовите полученные комплексные соединения, найдите их внешнюю и внутреннюю сферы и определите координационное число центрального атома.
