
- •1. Основные понятия теории растворов электролитов
- •2. Теория с Аррениуса/
- •3. Равновесие электролитической диссоциации в растворе
- •4. Ионное произведение воды
- •5. Водородный показатель. Расчет рН растворов кислот и оснований
- •1. Классификация кислотно-основных буферных систем:
- •Механизм действия буферных систем и расчетные формулы для определения рН в этих растворах
- •Вычисление рН буферных растворов Уравнение Гендерсона -Хассельбаха
- •2. Отсюда находим:
- •4. Буферная емкость. Факторы, определяющие буферную емкость
4. Буферная емкость. Факторы, определяющие буферную емкость
Количественной мерой устойчивости буферных систем является буферная емкость. Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к 1 литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле:
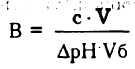
где В - буферная емкость; С - концентрация сильной кислоты или основания (моль/л); V - объем добавленного сильного электролита (л); V6 - объем буферного раствора (л); ∆рН - изменение рН.
Интервал значений водородного показателя (∆рН), в котором буферная система обладает буферными свойствами, называют зоной буферного действия.
Буферная емкость зависит от природы и общих концентраций компонентов буферного раствора, а также от отношения их концентраций. Чем больше концентрация компонентов буферного раствора и чем ближе отношение сНА/сВА и сВОН/сВА к единице, тем больше буферная емкость.. При сНА/сВА и свон/сВА, равных единице, буферная емкость максимальна.
-
Буферные системы крови и слюны
Кровь животных и человека представляет собой сложную буферную систему с рН в пределах 7.3-7.4. Значение рН крови на одном уровне поддерживается белками плазмы, гемоглобином, фосфатами, гидрокарбонатом натрия и угольной кислотой. Система угольная кислота — гидрокарбонат натрия регулирует содержание кислорода и оксида углерода в крови.
Мощность буферных систем плазмы крови уменьшается в ряду: водородкарбонатная, белковая, фосфатная, аминокислотная (изучить самостоятельно!!!!).
Буферные свойства слюны. Буферная емкость слюны, т. е. ее способность нейтрализовать кислоты и основания, обычно рассматривается как защитный механизм полости рта, функционирующий по принципу саморегуляции.
В полости рта действуют облигатные (всегда присутствующие) и факультативные (могут отсутствовать) факторы. К 1-ой группе относятся: слюна, пища, ротовая микрофлора, десневая жидкость, зубной камень, зубы; ко 2-ой группе — гигиенические средства, медикаменты, протезы.
Функция регуляции кислотно-основного баланса осуществляется слюной за счет ее буферных свойств. Буферная емкость обеспечивается тремя основными буферными системами: водородкарбонатной, фосфатной и белковой. Гидрокарбонатная буферная система обеспечивает 80 % буферных свойств слюны; концентрация гидрокарбонатов в слюне возрастает прямо пропорционально увеличению скорости секреции.
Буферная емкость значительно варьируется и может зависеть от характера питания, времени суток, состояния желудочно-кишечного тракта. Показатель рН слюны с увеличением скорости слюноотделения увеличивается, поэтому рН днем выше, чем ночью. Второй по значению считается фосфатная система, третьей — белковая.
