
2.1. Осмос, осмотическое давление; гипо–, гипер– и изотонические растворы. Закон Вант-Гоффа.
Осмос – это самопроизвольный переход растворителя (вода) через полупроницаемую перегородку в раствор с большей концентрацией. Чем выше концентрация раствора, тем резче выражен осмос.
Давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перегородкой, называется осмотическим давлением.
Растворы с одинаковым осмотическим давлением называют изотоническими. Если раствор по сравнению с другим имеет более высокое осмотическое давление, то его называют гипертоническим, а с более низким — гипотоническим.
Для осмотического давления (π, Па) разбавленного раствора расчетная формула аналогична уравнению состояния идеального газа:
|
|
где с – концентрация растворенного вещества, моль/л (c может быть заменена на моляльную m); Т –температура 0оС (273 К); R – универсальная газовая постоянная, не зависящая от природы газа. В системе СИ R=8,314103 Дж/(кмольК) или R=8,314Дж/(мольК); Х – неэлектролит (например, мочевина, сахароза, глюкоза). |
Это выражение, связывающее величину π с концентрацией и температурой неэлектролитов, известно как закон Вант – Гоффа.
-
Изотонический коэффициент.
Я Вант-Гофф обнаружил, что для электролитов осмотическое давление больше, чем рассчитанное по формуле (1), в i раз. В связи с этим для растворов электролитов:
π= iCRT (2), где i– изотонический коэффициент,
Из уравнения (2) ясен физический смысл изотонического коэффициента, который показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов больше, чем концентрация молекул до диссоциации.
Причем i>1 для электролитов (значение его увеличивается по мере разбавление электролита); i=1 для неэлектролитов; i< для веществ, склонных к ассоциации.
i зависит от природы электролита и степени диссоциации его молекул. В общем случае при распаде электролита с образованием К-ионов:
i =1+(К-1)α или α=i-1/К-1
(3)
Если при диссоциации молекулы образуется два иона (К=2) формула 3 примет простой вид: i= 1+ α (4)
При опытном определении степень диссоциации сильных электролитов всегда оказывается меньше 100%. Это объясняется проявлением электростатического притяжения между ионами, вследствие чего активность их уменьшается и создается видимость неполной диссоциации. Поэтому при вычислении степени диссоциации сильных электролитов говорят не об истинной, а о «кажущейся» степени диссоциации вещества в растворе.
Для растворов, в которых содержится смесь электролитов (к таким растворам относятся все биологические жидкости– моча, плазма, слюна и др.), расчет числа кинетически самостоятельных частиц затруднен. В связи с этим в медицине применяют такие понятия, как осмоляльность и осмолярность.
Под осмолярностъю (осмоляльностью– сосм) понимают активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембрану. Для разбавленных растворов можно принять, что численные значения осмоляльности и осмолярности совпадают. Математически осмолярность и осмоляльность определяют как ic (моль/л) и ib (моль/ кг) соответственно.
Обучающие задачи и эталоны их решений (используется уравнение Вант-Гоффа)
Задача 1. Осмотическое давление 0,1 М. ZnSO4 при 0°С равно 1,59-105 Па. Определить кажущуюся степень диссоциации соли в данном растворе.
Решение. Концентрация раствора ZnSO4 равна 0,05 моль/л, или 0,05 кмоль/м3. Для растворов электролитов применяем формулу (2), из которой находим изотонический коэффициент: π= iCRT, отсюда
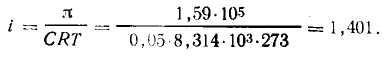
Соль ZnSO4 при диссоциации образует два иона (К=2). Согласно (4) i=1+α.
Отсюда α = i -1 = 1,401—1 =0,401 или α =40,1%.
Решить самостоятельно
Задача 2. Определить концентрацию раствора глюкозы, если раствор этого вещества при 18° С изотоничсн с раствором, содержащим 0,5 моль/л хлорида кальция. Кажущаяся степень диссоциации СаCI2 в растворе при указанной температуре составляет 65,4%.
Задача 3. Определите степень электролитической диссоциации (α) дихлоруксусной кислоты в водном растворе, в котором с(СНCI2СООН)=0,01 моль/л, если при 300 К этот раствор создает осмотическое давление в 43596, 4 Па.
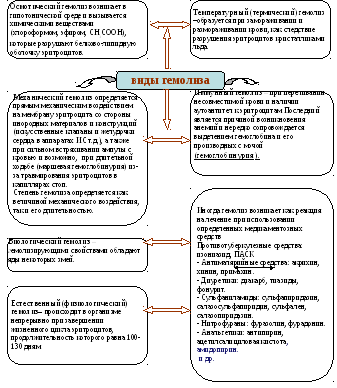
2.3. Роль осмоса в биологических системах. Гемолиз эритроцитов (схему см ниже) и причины
Осмотическое давление крови человека при температуре 310 К (37 °С) составляет 780 кПа (7,7 атм). Такое же давление создает и 0,9% водный раствор NaCI (0,15 моль/л), который, следовательно, изотоничен крови (физиологический раствор).
Во всех случаях, когда в кровяное русло, мышечную ткань, спинномозговой канал и т. д. с терапевтическими целями вводят растворы, необходимо помнить о том, чтобы эта процедура не привела к "осмотическому конфликту", из-за различия осмотических давлений вводимого раствора и данной системы организма.
Если, например, внутривенно ввести раствор, гипертонический по отношению к крови, то вследствие экзоосмоса эритроциты будут обезвоживаться и сморщиваться - плазмолиз.
Е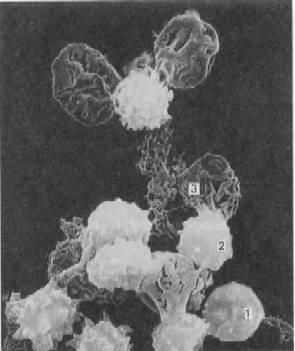 сли
же вводимый раствор гипотоничен
по отношению к крови, то
наблюдается "осмотический шок" и
вследствие эндоосмоса может произойти
разрыв эритроцитарных оболочек и
выход гемоглобина в плазму, благодаря
чему кровь приобретает лаковый цвет,
т.е. выглядит
как прозрачная красная жидкость.-
гемолиз.
В
результате концентрация гемоглобина
в крови растёт, а общее количества
циркулирующих эритроцитов при этом
снижается (гемолитическая анемия).
сли
же вводимый раствор гипотоничен
по отношению к крови, то
наблюдается "осмотический шок" и
вследствие эндоосмоса может произойти
разрыв эритроцитарных оболочек и
выход гемоглобина в плазму, благодаря
чему кровь приобретает лаковый цвет,
т.е. выглядит
как прозрачная красная жидкость.-
гемолиз.
В
результате концентрация гемоглобина
в крови растёт, а общее количества
циркулирующих эритроцитов при этом
снижается (гемолитическая анемия).
Начальная стадия гемолиза происходит при местном снижении осмотического давления до 360-400 кПа (3,5-3,9 ат или 0,42—0,48%), а полный гемолиз при 260-300 кПа (2.5-3,0 ат. или 0,30— 0,34%).
Рис. электронная микрофотография гемолиза эритроцитов и образование их “теней” (оболочки).
Обучающие задачи и эталоны их решения
Задача 4. Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы (ρ=1,006 г/мл)?
Решение. Эритроциты в гипотонических растворах за счет эндоосмоса лопаются, происходит гемолиз, а в гипертонических растворах — сморщиваются (цитолиз).
Осмотическое давление 2%-ного раствора глюкозы определяется по закону Вант-Гоффа:
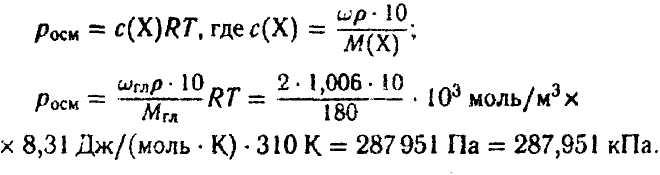
Ответ: π 2%-ного раствора глюкозы значительно меньше осмотического давления крови, поэтому с эритроцитами в таком растворе произойдет гемолиз («осмотический» шок).
Схема. Виды гемолиза
Задача 5. Рассчитайте осмотическое давление 20%-ного водного раствора глюкозы (ρ = 1,08 г/мл) при 310 К, применяемого для внутривенного введения, например при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что π крови равно 740-780 кПа?
2.4. Ионная сила. Коэффициент активности (теория Дебая—Хюккеля)
Неподчинение растворов сильных электролитов закону действия масс, а также законам Рауля и Вант-Гоффа объясняется тем, что эти законы применяются к идеальным газовым и жидким системам. При выводе и формулировке этих законов не учитывались силовые поля частиц, т.е. активность (Льюис предложил внести в науку понятие «активность»). Активностью (α) называется эффективная (кажущаяся) концентрация вещества (иона), соответственно которой ионы проявляют себя в химических процессах в качестве реальной действующей массы.
Активность иона а (моль/л) связана с его молярной концентрацией в растворе См соотношением: α=γСм, где γ (или f)– коэффициент активности иона (безразмерная величина).
Для характеристики зависимости активности ионов от концентрации всех находящихся в растворе ионов введено понятие «ионная сила» Ионная сила раствора (I или μ) равна половине суммы ионных концентраций С+ и С-, каждая из которых умножена на квадрат зарядности иона:
![]()
I
(5)
где с1 с2 и с3 —молярные концентрации отдельных ионов, присутствующие в растворе, a Z12, Z22 и Zn 2–их заряды, взятые в квадрате.
Так, например, если 1 л раствора содержит 0,005 моль нитрата меди Cu(NO3)2 и 0,001 моль сульфата алюминия A12(SO4)3 , то
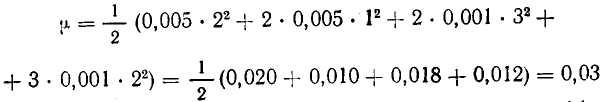
Если в растворе содержатся только однозарядные ионы, то ионная сила численно равна общему молярному содержанию их в растворе (I=с).
Например, вычислить ионную силу 0,01 М раствора хлорида калия КСI. Решение.
![]() ,
,
следовательно,
![]()
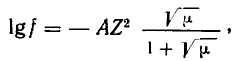 (6) где
А
—
множитель, величина которого зависит
от температуры (при
15°С А=0,5).
(6) где
А
—
множитель, величина которого зависит
от температуры (при
15°С А=0,5).
При значениях ионной силы раствора до 0,005 величина 1 + √μ очень близка к единице. В этом случае формула Дебая—Хюккеля приобретает более простой вид:
![]() (7)
(7)


 Ионная
сила раствора по Льюису
рассчитывается с использованием
моляльных концентраций ионов сm
(моль/кг):
Ионная
сила раствора по Льюису
рассчитывается с использованием
моляльных концентраций ионов сm
(моль/кг):
![]() (8)
где
n(Х)
— количество
растворенного
вещества в растворе; m(
S)
— масса растворителя.
(8)
где
n(Х)
— количество
растворенного
вещества в растворе; m(
S)
— масса растворителя.
Моляльную концентрацию используют для количественной характеристики растворов любых веществ. При приготовлении очень разбавленных растворов можно пренебречь изменением объема раствора, т. е. считать, что объем растворителя и раствора одинаков, и изменением плотности. Очевидно, что в этом случае молярная концентрация и моляльная концентрации примерно равны, однако при увеличении концентрации растворенного вещества расхождения в численных значениях двух способов выражения концентрации возрастают. Для пересчета пользуются следующими формулами:
![]() (9)
(9)
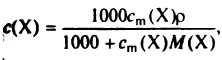 (10)
(10)
где с(Х) — молярная концентрация; M/(Х) — молярная масса вещества; ρ — плотность раствора (г/мл или кг/л).
Известно, что объем при изменении температуры изменяется, а масса — нет, поэтому значение молярной концентрации несколько изменяется при изменении температуры, а моляльная концентрация от температуры не зависит. При небольших концентрациях плотность раствора отличается от плотности воды незначительно, поэтому в данном случае можно считать, что с(Х) =сm(Х).
Ионная сила плазмы равна 0,167; эта величина поддерживается постоянной, поэтому практически все кровезаменители готовят таким образом, чтобы их ионная сила была примерно равна ионной силе плазмы.
Задача 8. Водный раствор сульфата меди (П) с массовой долей 1% (ρ=1,009 г/мл) назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе (Т = 298К).
Решение:
α (Cu2+) =γс(Cu2+)
Коэффициент активности γ можно рассчитать по уравнению Дебая—Хюккеля второго приближения:
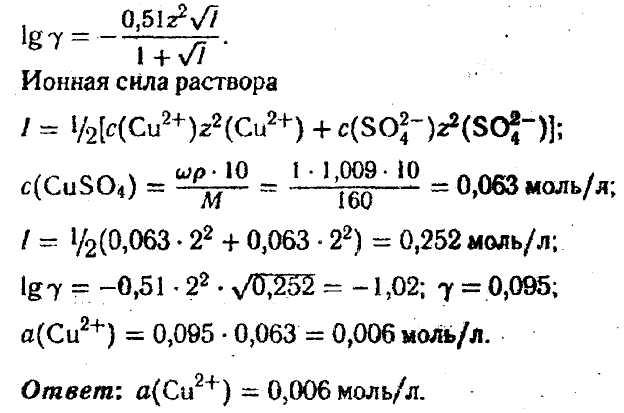

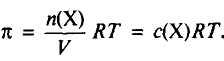 (1)
(1)