
- •Методичні вказівки щодо проведення лабораторних робіт
- •1 Загальні положення
- •2 Тематичний план лабораторних робіт
- •3 Методичні вказівки щодо виконання лабораторних робіт
- •Правила техніки безпеки при проведені лабораторних робіт
- •3.2. Підготовка до лабораторної роботи та її захист
- •Лабораторна робота № 1
- •Короткі теоретичні положення
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Оформлення роботи
- •Захист роботи:
- •На скільки процентів змінився б період коливань, коли б його довжина змінилась на 0,1%? Лабораторна робота № 4
- •Короткі теоретичні положення
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Порядок проведення лабораторної роботи:
- •Оформлення роботи
- •Захист роботи:
- •4 Перелік навчально–методичної літератури
Порядок проведення лабораторної роботи:
-
Повільно вивертати гвинт тримача до тих пір, поки не розірветься плівка води, яка тягнеться за демонстраційною петлею.
-
Замітити по шкалі динамометра, при якій силі розірвалась плівка.
-
Обчислити коефіцієнт поверхневого натягу досліджуваної рідини за формулою:
![]() ,
,
-
де G – коефіцієнт поверхневого натягу рідини, F – сила, I – полупериметр петлі, указаний на футлярі (в мм).
-
Провести ще два вимірювання G.
-
Визначити похибки:
7.1 Розрахувати середній коефіцієнт поверхневого натягу рідини виходячи з трьох експериментів за формулою:
![]() .
.
7.2 Визначити абсолютну похибку Δ для кожного обчисленого значення G:
![]() .
.
7.3 Визначити середню абсолютну похибку
![]() :
:
![]() .
.
7.4 Визначити відносну похибку δ вимірювання G:
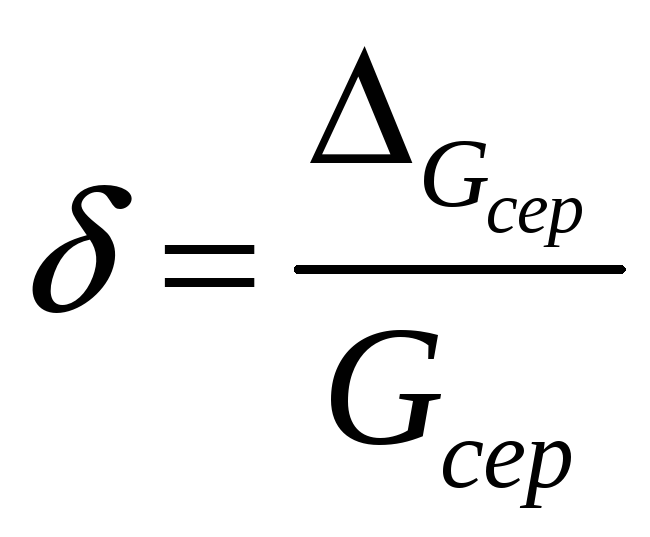 .
.
-
Занести дані в таблицю:
№ досл.
F, Н
l, м
G, Н/м
Gсер, Н/м
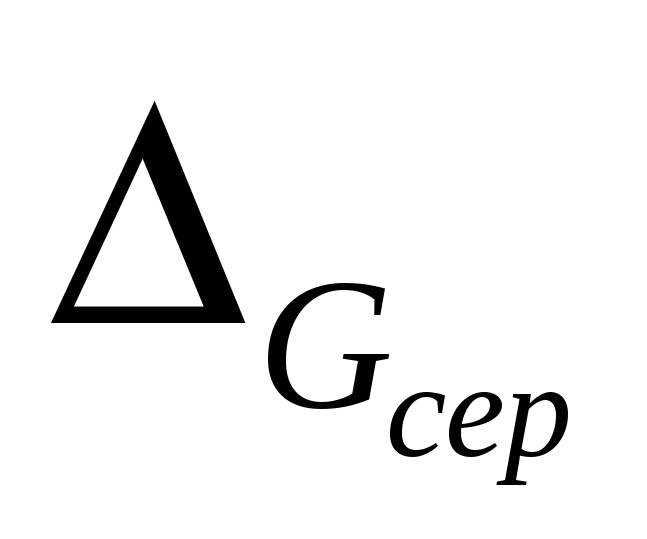 ,
Н/м
,
Н/мδ, %
1
2
3
-
У такій же послідовності виконати вимірювання коефіцієнта поверхневого натягу спирту та обчислити похибки.
-
Дані занести в таблицю:
|
№ досл. |
F, Н |
l, м |
G, Н/м |
Gсер, Н/м |
|
δ, % |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
-
Написати висновки.
Оформлення роботи
Звіт з виконання лабораторної робити роботи повинен мати в собі: титульний лист, короткі тезиси з теорії, дані вимірювань, обчислення, таблицю з результатами обчислень, висновки. Якщо звіт оформлюється рукописно, то необхідно звернути увагу на каліграфію при письмі.
Захист роботи:
-
Що характеризує F у формулі?
-
Де у природі можна помітити дію сил поверхневого натягу?
-
Завдяки якому ефекту рідина має явище поверхневий натягу?
-
Які речовини застосовують для зменшення поверхневого натягу?
-
Чому, на вашу думку, значення коефіцієнтів п. н. для води та спирту різняться?
Лабораторна робота № 6
Тема роботи: „ Перевірка об’єднаного газового закону “
Мета роботи: Перевірити на практиці об’єднаний газовий закон.
Обладнання:
-
Хімічна колба.
-
Пробірка.
-
Термометр.
-
Лінійка.
Короткі теоретичні положення
Ідеальний газ – це газ, в якому молекули можна вважати матеріальними точками, а силами притягання і відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази, тиск в яких не перевищує 200 атмосфер і які перебувають при низькій температурі, оскільки за таких умов відстань між молекулами набагато перевищує їх розміри.
Стан класичного ідеального газу описується рівнянням стану ідеального газу:
![]() ,
,
де P – тиск, V – об’єм, n –
кількість речовини, R – універсальна
газова стала (8,31
![]() ),
T – абсолютна (термодинамічна)
температура, N – кількість молекул,
kB – стала Больцмана (1,38 ·
10-23
),
T – абсолютна (термодинамічна)
температура, N – кількість молекул,
kB – стала Больцмана (1,38 ·
10-23
![]() ).
).
Рівняння стану ідеального газу – формула, що встановлює залежність між тиском, молярним об’ємом і абсолютною температурою класичного ідеального газу. Рівняння має вигляд:
![]() ,
,
де V
– молярний об’єм (22,41 · 10-3![]() ).
).
Оскільки:
![]() ,
,
де – кількість речовини, то рівняння можна записати у вигляді:
![]() ,
,
![]() .
.
Останнє рівняння називають рівнянням об’єднаного газового закону. Тобто, як би не змінювалися три основні параметри термодинамічної системи (P, V, T), добуток тиску (P) на об’єм (V), поділений на термодинамічну температуру (T) залишаться сталим, якщо виконується умова незмінної кількості молекул термодинамічної системи.
