
- •Теоретические основы теплотехники
- •Теоретические основы теплотехники
- •Порядок выполнения работы:
- •Обработка результатов эксперимента
- •Содержание и оформление отчета
- •Контрольные вопросы для самопроверки
- •Порядок выполнения работы
- •Обработка результатов эксперимента
- •Содержание и оформление отчета по работе
- •Контрольные вопросы для самопроверки
- •Основные теоретические положения
- •Процессы изменения состояния влажного воздуха
- •Содержание и оформление отчета по работе
- •Контрольные вопросы для самопроверки
- •Основные теоретические положения
- •Фазовая I-s диаграмма водяного пара
- •Процессы изменения состояния водяного пара
- •Содержание и оформление отчета по работе
- •Контрольные вопросы для самопроверки
- •Литература
- •Порядок выполнения работы
- •Обработка результатов эксперимента
- •Содержание и оформление отчета по работе
- •Контрольные вопросы для самопроверки
- •Порядок выполнения работы
- •Обработка результатов эксперимента
- •Содержание и оформление отчета по работе
- •Контрольные вопросы для самопроверки
- •Порядок выполнения работы:
- •Обработка результатов эксперимента
- •Содержание и оформление отчета по работе
- •Контрольные вопросы для самопроверки
- •Литература
- •Литература
- •Карнаух Вікторія Вікторівна, старший викладач
- •Теоретичні основи теплотехніки
- •83023, М. Донецьк, вул. Харитонова, 10. Тел.: (062) 97-60-45
Основные теоретические положения
Известно, что все вещества в зависимости от физических условий находятся в твердом, газообразном или жидком состоянии. Переход из одного состояния в другое называется фазовым переходом. Фазовое превращение из жидкого состояния в газообразное называется парообразованием, из газового в жидкое – конденсацией. Процесс образования пара по всей массе жидкости называется кипением. Процесс кипения может происходить только при подводе тепла, а конденсации – при отводе тепла. Фазовый переход происходит при постоянной температуре, которая называется температурой насыщения. То есть температура может быть названа в одном случае температурой кипения, в другом – температурой конденсации.
Температура насыщения зависит от давления. С повышением давления температура насыщения повышается, и наоборот – с понижением давления температура насыщения понижается. При одном и том же давлении температура насыщения для разных тел различна.
Жидкость, имеющая температуру насыщения, называется насыщенной жидкостью; соответственно пар, имеющий температуру насыщения, называется насыщенным паром. Смесь жидкости и пара при температуре насыщения называется влажным насыщенным паром. Этот пар (влажный) характеризуется степенью сухости (паросодержанием) - х или степенью влажности (влагосодержания) – y=1-x. Степень сухости изменяется в диапазоне 0х1. При х=0 вещество находится в состоянии насыщенной жидкости, при х=1 - в состоянии сухого насыщенного пара; при 0х1 имеет место двухфазная система - влажный насыщенный пар - смесь насыщенной жидкости и сухого насыщенного пара. Пар, имеющий температуру выше температуры насыщения, называется перегретым паром, а жидкость, имеющая температуру ниже температуры насыщения называется холодной или ненасыщенной жидкостью.
Для реальных газов (паров) не пригодно уравнение состояния идеальных газов, т.е. pRT. Уравнение состояния для паров весьма сложно и в расчетной практике не применяется. Вследствие этого используют таблицы и диаграммы, составленные на основании опытных и теоретических данных.
Фазовая I-s диаграмма водяного пара
Для практических расчетов процессов водяного пара широкое применение получила фазовая i-s диаграмма (рис. 1).
По
оси абсцисс указывается удельная
энтропия s
![]() ,
по оси ординат – удельная энтальпия i
,
по оси ординат – удельная энтальпия i
![]() .
Все диаграммы составляются для 1кг
вещества. Линии с постоянным значением
энтальпии (i-const)
- горизонтальные линии (перпендикулярны
оси ординат). Линии с постоянным значением
энтропии (s-const)
- вертикальные линии (перпендикулярны
оси абсцисс). Все поле диаграммы делится
пограничными кривыми – нижней x=0
и верхней x=1
на три области: жидкого состояния
рабочего тела, состояние влажного пара
и состояние перегретого пара. Нижняя
пограничная кривая х=0
– это линия насыщенной жидкости. Верхняя
пограничная кривая х=1
– это линия сухого насыщенного пара.
Между этими кривыми двухфазное состояние
рабочего тела – влажный пар. Все линии
с постоянным значением степени сухости
(паросодержания) – х-const,
в том числе и х=0
и х=1,
сходятся в одной точке К
- критической точке. Параметры,
соответствующие этой точке, называются
критическими. Для воды критические
параметры имеют следующие значения:
.
Все диаграммы составляются для 1кг
вещества. Линии с постоянным значением
энтальпии (i-const)
- горизонтальные линии (перпендикулярны
оси ординат). Линии с постоянным значением
энтропии (s-const)
- вертикальные линии (перпендикулярны
оси абсцисс). Все поле диаграммы делится
пограничными кривыми – нижней x=0
и верхней x=1
на три области: жидкого состояния
рабочего тела, состояние влажного пара
и состояние перегретого пара. Нижняя
пограничная кривая х=0
– это линия насыщенной жидкости. Верхняя
пограничная кривая х=1
– это линия сухого насыщенного пара.
Между этими кривыми двухфазное состояние
рабочего тела – влажный пар. Все линии
с постоянным значением степени сухости
(паросодержания) – х-const,
в том числе и х=0
и х=1,
сходятся в одной точке К
- критической точке. Параметры,
соответствующие этой точке, называются
критическими. Для воды критические
параметры имеют следующие значения:
![]() ;
;
![]() ;
;
![]() .
Выше критической точки переход из
жидкого состояния в газообразное
происходит, непосредственно минуя
стадию двухфазного состояния, и четкую
границу между жидкостью и паром установить
невозможно.
.
Выше критической точки переход из
жидкого состояния в газообразное
происходит, непосредственно минуя
стадию двухфазного состояния, и четкую
границу между жидкостью и паром установить
невозможно.
Итак, линии х-const находятся только в области влажного пара, все они выходят из критической точки. Значение этого параметра изменяется от 0 до 1 и указываются на некоторых изолиниях.
Изобары
р-const
и изотермы t-const
в области влажного пара совпадают
(каждому значению p
соответствует свое значение температуры
насыщения
![]() ).
Эти линии р-const
и t-const
представляют собой прямые линии с
постоянным угловым коэффициентом. В
области перегретого пара (начиная с
пограничной кривой x=1)
изобары и изотермы расходятся, причем
изобары поднимаются кверху в виде
логарифмических кривых, а изотермы
стремятся к горизонтали. Это объясняется
тем, что с понижением давления перегретый
пар по свойствам приближается к идеальному
газу, энтальпия которого зависит только
от температуры, т.е. линии t-const
одновременно являются линиями i-const.
).
Эти линии р-const
и t-const
представляют собой прямые линии с
постоянным угловым коэффициентом. В
области перегретого пара (начиная с
пограничной кривой x=1)
изобары и изотермы расходятся, причем
изобары поднимаются кверху в виде
логарифмических кривых, а изотермы
стремятся к горизонтали. Это объясняется
тем, что с понижением давления перегретый
пар по свойствам приближается к идеальному
газу, энтальпия которого зависит только
от температуры, т.е. линии t-const
одновременно являются линиями i-const.
Значения изобар указываются в области влажного пара (на линии x=0,9) и в области перегретого пара (в самом верху диаграммы по линии t=800oC) от 0,001 до 100 МПа.
Значения изотерм указываются только в области перегретого пара (в области влажного пара изотермы являются одновременно и изобарами) от 50 до 800оС.
Изохоры -const идут несколько круче изобар (пунктирные линии). Значения изохор указываются в области влажного пара, на линии сухого насыщенного пара и в области перегретого пара от 0,005 до 50 м3/кг.
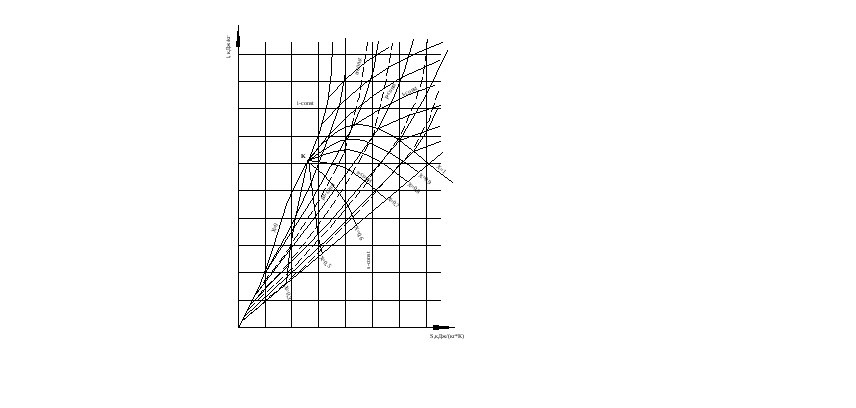
Рисунок 1 – Фазовая диаграмма водяного пара
