
- •2. Как влияет температура на различные виды поляризации ( электронную, атомную, ориентационную).
- •28.Что называется термодинамическими параметрами системы. Приведите примеры интенсивных и экстенсивных параметров состояния.
- •39. Стандартное состояние вещества. Стандартная энтальпия химической реакции.
- •Первый закон Коновалова
- •92.У одного из двух водных 0,005 м растворов – раствора глюкозы или раствора сульфата натрия – осмотическое давление (при одинаковой температуре ) больше. Почему
- •130.Роль свободных радикалов в химической кинетике. Механизм возникновения свободных радикалов.
- •Образование
- •20. Используя данные таблицы 3 вычислить величину электричеcкого дипольного момента молекулы вещества .
- •125.При 40 с давление пара хлороформа равно 49 198 Па, а при температуре 50 с 71 330 Па. Вычислить энтальпию испарения , температуру кипения и энтропию испарения при температуре испарения.
- •178. Вычислить энергии активации химических реакций по данным о константах скоростей k при разных температурах t
- •Для большинства реакции зависимость скорости реакции и константы скорости реакции зависит от температуры и выражается экспоненциальной зависимостью
- •Список литературы
125.При 40 с давление пара хлороформа равно 49 198 Па, а при температуре 50 с 71 330 Па. Вычислить энтальпию испарения , температуру кипения и энтропию испарения при температуре испарения.
По этому уравнению можно рассчитать энтальпию испарения или возгонки, исходя из значений давления пара при двух разных температурах.
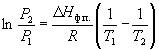
|
|
1 состояние |
2 состояние |
|
P, Па |
49 198 |
71 330 |
|
T, K |
313 |
323 |
ln ( 71330/49198 ) = l n 1,449 =0,3708736633385
1 / T1 = 1/ 313= 0,00319
1 / T2 = 1/323= 0, 00309
1 / T1 - 1 / T2 = 0,00319 - 0, 00309 = 0,0001
∆H = 0,37087 * 8,3144 / 0,0001 = 30 835 ,6 Дж
Правило Трутона: молярная энтропия испарения разных веществ при нормальной температуре кипения является постоянной величиной и равняется константе Трутона:
![]()
![]() Дж/(моль·К)[1]
Дж/(моль·К)[1]
T кип = 30 835 ,6 / 88 = 350, 4 K
158.Электродвижущаяся сила элемента Даниеля- Якоби , в котором концентрация Cu 2+ и Zn 2+ равны при 18 С 1,1 В. Вычислить ЭДС цепи, в которой концентрация Cu 2+ 0,00003, концентрация Zn 2+ 0,2.…
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
![]()
![]()
![]()
![]()
![]()
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
![]() =
1,1
=
1,1
T [K] = t [°C] + 273.15 = 18 + 273,15 = 288,15 K
E = 1,1 + (288,15 * 8,31441 / ( 2 * 96484, 56 ) )* ln (0,0003 /0,2) = 1,1+ 0,1241 ln 0,0015 = 1,1 +0,1241 * 6,5 = 1,906 В
178. Вычислить энергии активации химических реакций по данным о константах скоростей k при разных температурах t
N204 →2N02
|
T , K |
K |
|
300 |
3,288 * 10 6 |
|
330 |
2,398 * 10 7 |
Для большинства реакции зависимость скорости реакции и константы скорости реакции зависит от температуры и выражается экспоненциальной зависимостью
k = Аe-E/RT
Энергию активации можно определить, измерив константу скорости при двух температурах:
![]()
E a = ( 8,31441 * 330* 300 / ( 330-300 ) ) ln( 2,398 * 10 7/3,288 * 10 6) = 27437 ln 7, 2931 = 27437 *1,98 = 54325,29 Дж
Список литературы
-
В.И.Горшков, И.А.Кузнецов. Основы физической химии. М. МГУ, 1993.
-
В.И.Горшков, И.А.Кузнецов. Физическая химия. М. МГУ, 1986.
-
В.И.Горшков, И.А.Кузнецов. Физическая химия. Методические указания. М. МГУ, 1988.
-
Л.Лабовиц, Дж.Аренс. Задачи по физической химии с решениями. М. Мир, 1972.
-
Краткий справочник физико-химических величин ,м., 2000 .
