
- •2. Как влияет температура на различные виды поляризации ( электронную, атомную, ориентационную).
- •28.Что называется термодинамическими параметрами системы. Приведите примеры интенсивных и экстенсивных параметров состояния.
- •39. Стандартное состояние вещества. Стандартная энтальпия химической реакции.
- •Первый закон Коновалова
- •92.У одного из двух водных 0,005 м растворов – раствора глюкозы или раствора сульфата натрия – осмотическое давление (при одинаковой температуре ) больше. Почему
- •130.Роль свободных радикалов в химической кинетике. Механизм возникновения свободных радикалов.
- •Образование
- •20. Используя данные таблицы 3 вычислить величину электричеcкого дипольного момента молекулы вещества .
- •125.При 40 с давление пара хлороформа равно 49 198 Па, а при температуре 50 с 71 330 Па. Вычислить энтальпию испарения , температуру кипения и энтропию испарения при температуре испарения.
- •178. Вычислить энергии активации химических реакций по данным о константах скоростей k при разных температурах t
- •Для большинства реакции зависимость скорости реакции и константы скорости реакции зависит от температуры и выражается экспоненциальной зависимостью
- •Список литературы
130.Роль свободных радикалов в химической кинетике. Механизм возникновения свободных радикалов.
Свободные радикалы в химии — частицы (как правило, неустойчивые), содержащие один или несколько неспаренных электронов. По другому определению свободный радикал — вид молекулы или атома, способный к независимому существованию (то есть обладающий относительной стабильностью) и имеющий один или два неспаренных электрона. Неспаренный электрон занимает атомную или молекулярную орбиталь в одиночку. Как правило, радикалы обладают парамагнитными свойствами, так как наличие неспаренных электронов вызывает взаимодействие с магнитным полем. Кроме этого наличие неспаренного электрона способно значительно усилить реакционную способность, хотя это свойство радикалов широко варьируется
Образование
Радикал может образоваться в результате потери одного электрона нерадикальной молекулой:
-
X → e− + X·+
или при получении одного электрона нерадикальной молекулой:
-
Y + e− → Y·−
Большинство радикалов образуются в ходе химических реакций при гомолитической диссоциации связей. Они сразу же претерпевают дальнейшие превращения в более устойчивые частицы: Cl2 → 2Cl· СН4 + Cl· → CH3· + HCl CH3· + Cl2 → CH3Cl + Cl· 2Cl· → Cl2 2CH3· → C2H6 … Зарождение радикальной цепи можно инициировать действием на вещество жестких условий (высокие температуры, электромагнитное излучение, радиация). Многие перекисные соединения — также хорошие радикалообразующие частицы. Косвенное действие ионизирующего излучения связано с образованием свободных радикалов. Особенно велика роль свободных радикалов в кинетике цепных 'реакций. Поэтому вполне естественным является повышенный интерес к химии свободных радикалов.
20. Используя данные таблицы 3 вычислить величину электричеcкого дипольного момента молекулы вещества .
Дано : вещество: Хлористый этил С2Н3Сl
|
|
Температура , К |
|||
|
|
283 |
293 |
298 |
300 |
|
P * 10 -3 кг/м 3 |
0,904 |
0,898 |
0,89 |
0,883 |
|
ε |
7,64 |
6,94 |
6,34 |
5,7 |
Из всех методов получили наиболее широкое распространение методы определения дипольных моментов, основанные на измерении диэлектрической проницаемости (ε) вещества. Этими методами измерены дипольные моменты молекул более 10000 веществ. Переход от измеряемого значения ε газа, чистой жидкости или разбавленного раствора, т.е. макроскопической характеристики диэлектрика, к величине дипольного момента основан на теории поляризации диэлектриков. Считается, что при наложении электрического поля на диэлектрик его полная поляризация Р складывается из наведенной или индуцированной поляризации Рм и поляризации Рор и связана с μ уравнением Ланжевена-Дебая (2).
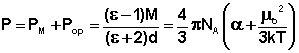 (2)
(2)
где М – молекулярная масса, d – плотность, α - поляризуемость молекулы, NA - число Авогадро, k – постоянная Больцмана, Т – абсолютная температура.
M (С2Н3Сl) = 62,5
Na =6,23 * 10 23 моль -1
K = 1,38 * 10 -23 Дж/K
Р
|
|
283 |
293 |
|
P * 10 -3 кг/м 3 |
0,904 |
0,898 |
|
ε |
7,64 |
6,94 |
|
( ε -1) M |
415 |
371,25 |
|
(ε +2) *d |
8,96*10 -3 |
8,028*10 -3 |
|
( ε -1) M/ ε +2) *d |
46,316 10 3 |
46,244*10 3 |
|
4/3 * пNa |
2,645*10 23 |
2,645*10 23 |
|
3kT |
1171,62*10 -23 |
1213,02 10 -23 |
|
46,316 10 3 ./2,645*10 23 |
17,51 *10 -20 |
|
|
46,244 10 3 ./2,645*10 |
|
17,48*10 -20 |
Составим систему уравнений из 2 неизвестных:
При T = 283 46,316 10 3 = 2,645*10 23 ( a + μ2/1171,62*10 -23)
При Т = 293 46,244*10 3= 2,645*10 23 ( a + μ2/1213*10 -23)
Решаем систему:
17,51*10 -20 = a + μ2/1171,62*10 -23
17,48*10 -20 = a + μ2/1213,62*10 -23
Из 1 уравнения находим a
a = 17,51*10 -20- μ2/1171,62*10 -23
и подставляем во 2 уравнение
17,48*10 -20= 17,51*10 -20- μ2/1171,62*10 -23 + μ2/1213,62*10 -23
Решаем относительно μ
-μ2/1213,62*10 -23+μ2/1171,62*10 -23 = 17,51*10 -20 - 17,48 * 10 -20
-μ2/1213,62*10 -23+ μ2/1171,62*10 -23 = 0,03 * 10 -20
μ = 3,18 * 10 14 Kл м
110.Газообразные вещеcтва А и Б реагируют с образованием продукта С . Рассчитайте Kр и Kc если исходные вещества А и Б взяты в стехиометрических количествах при общем давлении равновесной системы 1,0133 10 5 ПА и температуре 298 К . Количество вещества С равно 0,35.
3А + ½ Б = 3 C
Для обратимой химической реакции, протекающей при некоторой температуре, устанавливаются любые, но постоянные равновесные концентрации [А], [В], [С], [D]. Они не зависят друг от друга, а определяются только положением состояния равновесия. В соответствии с законом действующих масс состояние равновесной химической системы характеризуется константой равновесия:
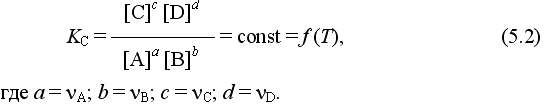
Kc = ( 0,35) 3/( ( 3-0,35) 3 * ( 0,5-0,35 ) ½ ) = 0,025
Кс и Кр связаны между собой соотношениями:
KP = KC (RT) c+d–a–b = KXP c+d–a–
3 – 3-,05 = -,05
K p = Kc * (RT)-0,5 = 0, 025 * ( 8,3144 * 298 ) -0,5 = 1,24
