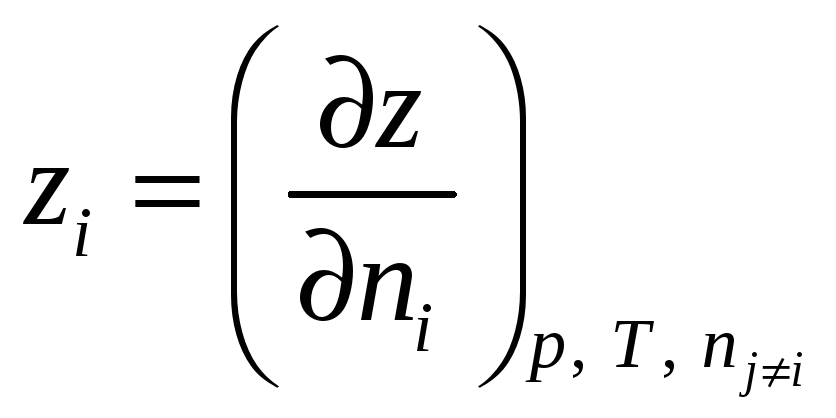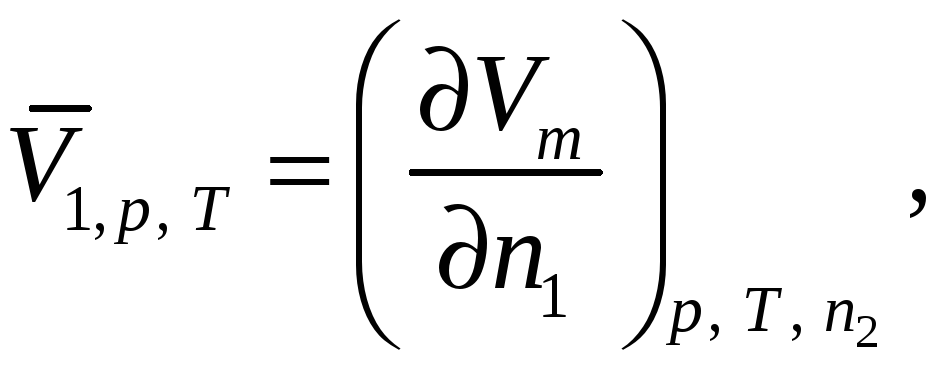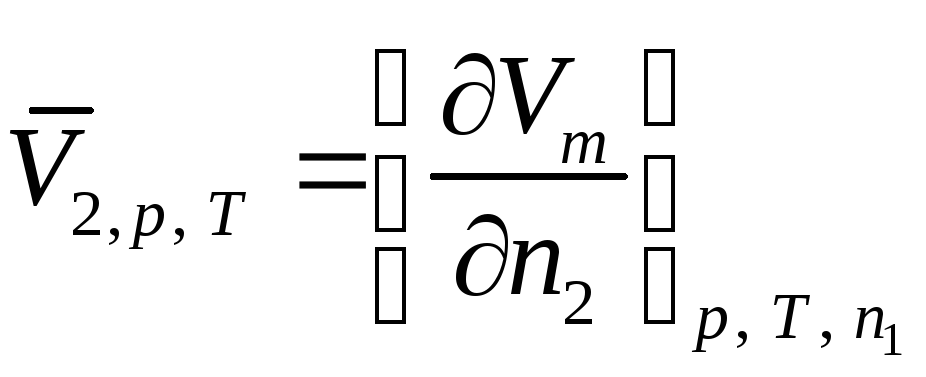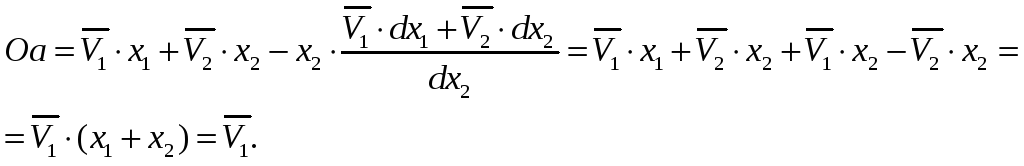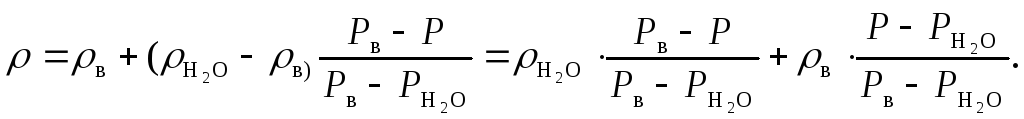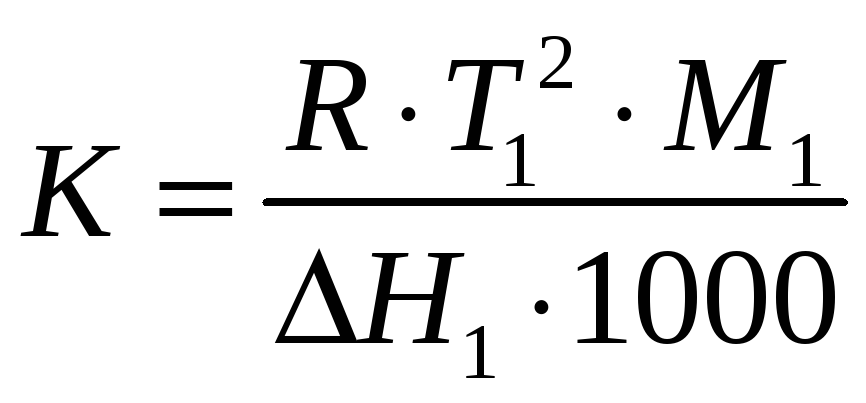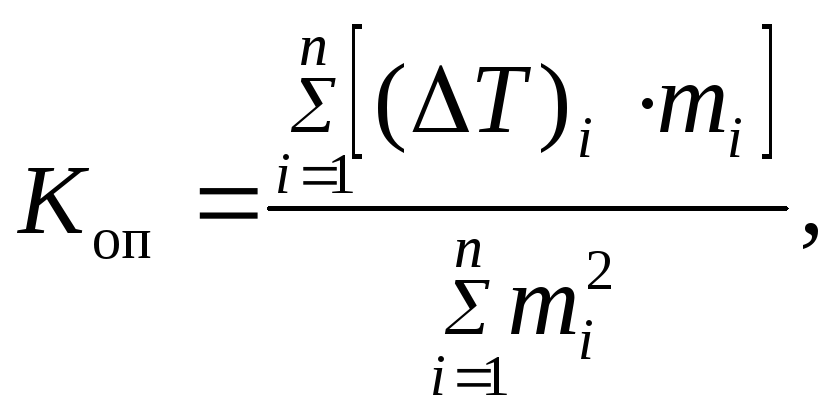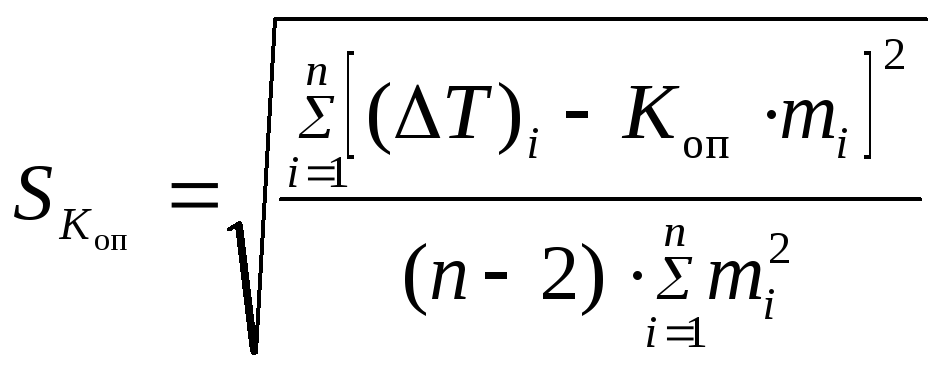- •Оценка погрешностей измерений
- •4. Термодинамика
- •Теоретическая часть
- •Методика и порядок проведения работы
- •Результаты работы
- •Вопросы для самоконтроля
- •Обработка результатов
- •Вопросы для самоконтроля
- •Теоретические сведения
- •Результаты опыта
- •Вопросы для самоконтроля
- •5. Растворы
- •Теоретические сведения
Результаты опыта
-
Исследуемая соль
Теплота растворения, кДж/моль

Справочные данные

Отчет о работе завершают выводами.
Вопросы для самоконтроля
-
Что называют интегральной и дифференциальной теплотами растворения?
-
Как связана прочность кристаллической решетки соли и теплота ее растворения?
-
Какое влияние оказывает природа катиона или аниона на теплоту растворения соли?
-
Известно, что при растворении двух солей с общим катионом для соли с более слабым анионом теплота растворения выше. Что можно сказать о влиянии природы аниона на соотношение теплот плавления этих солей и смешения их с водой?
-
В чем суть калориметрического определения теплоты растворения? Как определить величину
 ,
необходимую для расчета теплоты?
,
необходимую для расчета теплоты?
5. Растворы
Работа № 4. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА РАСПРЕДЕЛЕНИЯ ВЕЩЕСТВА В ДВУХ НЕСМЕШИВАЮЩИХСЯ ЖИДКОСТЯХ
Целью работы является изучение коэффициента распределения ионов меди между водой и органической жидкостью при комнатной температуре.
При подготовке к работе следует ознакомиться со следующими разделами теоретического курса: правило фаз Гиббса, закон распределения, активности компонентов разбавленных, идеальных и реальных растворов.
Теоретические сведения
Рассмотрим систему из двух чистых жидкостей, нерастворимых друг в друге, при этом жидкости образуют два слоя. Если в такую систему добавить третье вещество, растворимое в обеих жидкостях (третий компонент), то после достижения равновесия этот третий компонент распределится между обоими слоями, образуя два раствора различной концентрации.
Согласно
правилу фаз Гиббса число степеней
свободы трехкомпонентной (![]() )
двухфазной (
)
двухфазной (![]() )
системы равно трем:
)
системы равно трем:
|
|
(40) |
Таким
образом, из трех параметров, характеризующих
равновесие системы (температура
![]() и концентрации растворенного вещества
в двух фазах
и концентрации растворенного вещества
в двух фазах![]() ), произвольно можно изменять лишь два.
Третий параметр является функцией двух
независимых переменных. При постоянной
), произвольно можно изменять лишь два.
Третий параметр является функцией двух
независимых переменных. При постоянной
![]() концентрация растворенного вещества
«i»
в одной из фаз является функцией его
концентрации в другой фазе, т.е.
концентрация растворенного вещества
«i»
в одной из фаз является функцией его
концентрации в другой фазе, т.е.
![]() .
Другими словами, при равновесии двух
фаз концентрации растворенного вещества
«i»
в них взаимно связаны. Эта связь выражается
законом распределения вещества между
двумя несмешивающимися жидкостями,
согласно которому константа распределения,
равная отношению активностей растворенного
вещества в разновесных фазах является
однозначной функцией температуры.
.
Другими словами, при равновесии двух
фаз концентрации растворенного вещества
«i»
в них взаимно связаны. Эта связь выражается
законом распределения вещества между
двумя несмешивающимися жидкостями,
согласно которому константа распределения,
равная отношению активностей растворенного
вещества в разновесных фазах является
однозначной функцией температуры.
|
|
(41) |
Вывод
уравнения (41) основан на условии равновесия
системы: химические потенциалы
растворенного вещества одинаковы в
обеих фазах, т.е.
![]() .
.
Используя известное соотношение
|
|
(42) |
в
котором
![]() относится к стандартному состоянию, и
приравнивая потенциалы
относится к стандартному состоянию, и
приравнивая потенциалы
![]() и
и
![]() вещества «i»,
приходим к равенству:
вещества «i»,
приходим к равенству:
|
|
(43) |
Поскольку
стандартные потенциалы компонента «i»
в каждой из фаз
![]() и
и
![]() зависят лишь от температуры, отношение
активностей компонента, называемое
константой распределения, является
также функцией только температуры и не
зависит от состава растворов.
зависят лишь от температуры, отношение
активностей компонента, называемое
константой распределения, является
также функцией только температуры и не
зависит от состава растворов.
В реальных растворах активность компонента
|
|
(44) |
поэтому
вместо константы распределения удобнее
использовать коэффициент распределения
![]() ,
равный отношению концентраций
растворенного вещества в равновесных
фазах
,
равный отношению концентраций
растворенного вещества в равновесных
фазах
|
|
(45) |
Коэффициент
распределения является функцией состава,
поскольку коэффициенты активности
![]() и
и
![]() зависят от концентрации раствора.
зависят от концентрации раствора.
В бесконечно разбавленных растворах коэффициент активности растворенного вещества постоянен, поэтому здесь не только константа, но и коэффициент распределения не зависят от состава равновесных фаз.
В
бесконечно разбавленном растворе все
величины, характеризующие состав,
пропорциональны друг другу (![]() ).
Поэтому здесь коэффициент распределения
может быть выражен через отношение
равновесных концентраций в любых
единицах, например,
).
Поэтому здесь коэффициент распределения
может быть выражен через отношение
равновесных концентраций в любых
единицах, например,
|
|
(46) |
Значения
![]() при этом получаются различными, но во
всех случаях они не зависят от состава.
при этом получаются различными, но во
всех случаях они не зависят от состава.
Измерение
коэффициента распределения позволяет
определять активности растворенного
вещества. Для этого бинарный раствор с
известной зависимостью активности
компонентов от состава приводят в
контакт с несмешивающейся жидкостью,
содержащей общий с первой фазой компонент,
активность которого неизвестна. После
установления равновесия измеряют
концентрации
![]() и
и
![]() растворенного вещества в каждой из фаз
для растворов различного состава.
Находят соответствующие значения
отношений
растворенного вещества в каждой из фаз
для растворов различного состава.
Находят соответствующие значения
отношений
![]() и строят график зависимости этого
отношения от концентрации третьего
компонента в растворах с известными
активностями. Экстраполируя полученную
линию до нулевой концентрации (
и строят график зависимости этого
отношения от концентрации третьего
компонента в растворах с известными
активностями. Экстраполируя полученную
линию до нулевой концентрации (![]() ),
на оси ординат получают значение
константы распределения для
бесконечно-разбавленного раствора. Для
таких растворов, как уже отмечалось,
отношение концентраций растворенного
вещества не зависит от состава растворов.
Зная это отношение и величины активностей
растворенного вещества в одном из
растворителей, рассчитывают активности
третьего компонента в другом растворителе
при всех исследованных концентрациях.
),
на оси ординат получают значение
константы распределения для
бесконечно-разбавленного раствора. Для
таких растворов, как уже отмечалось,
отношение концентраций растворенного
вещества не зависит от состава растворов.
Зная это отношение и величины активностей
растворенного вещества в одном из
растворителей, рассчитывают активности
третьего компонента в другом растворителе
при всех исследованных концентрациях.
Закон распределения имеет и другое важное практическое значение. Из предыдущих уравнений следует, что для понижения концентрации растворенного вещества в одной фазе при постоянных температуре и давлении необходимо понизить его концентрацию в другой. Последнее может быть достигнуто разбавлением одной из фаз. В частности, при производстве стали для очистки металла от вредных примесей (фосфора, серы и др.) либо увеличивают количество шлака, либо удаляют шлак, содержащий вредную примесь, и наводят новый. Так как при постоянной температуре константа распределения примеси остается величиной постоянной, то часть примеси переходит из металла в новый шлак и концентрация ее в металле уменьшается. Такое извлечение растворенного вещества из раствора называется экстракцией.
Очевидно,
экстракция будет тем эффективнее, чем
больше коэффициент распределения
отличается от единицы. Коэффициент
распределения можно менять, добавляя
в растворы вещества, меняющие коэффициенты
активности данного компонента «i».
Так, введение вещества, имеющего большее
сродство к данному компоненту, чем
растворитель, снижает коэффициент
активности этого компонента и,
следовательно, изменяет величину
коэффициента
![]() .
.
Порядок выполнения работы
Работа выполняется на виртуальной модели, которые часто применяются в случае, если изучение объекта экономически не обосновано, осложнено экспериментально или не безопасно. Виртуальная модель включает в себя смысловую модель, на основе которой разрабатывается математическая модель. По уравнениям мат. модели с помощью компьютера осуществляется графическое представление процесса.
Выполняемая виртуальная работа основана на реальном процессе выделения ионов меди из водного раствора при соприкосновении данного раствора с органической фазой представляющей собой раствор Д2ЭГФК ( Ди 2-этил-гексил фосфорная кислота) 30 мас.% в керосине. При протекании такого процесса основное количество Cu2+ переходит в органическую фазу, а концентрация Cu2+ в водном растворе существенно снижается.
Для выполнения работы следует подать в емкость 1 (Рис.8) по трубке 3 с помощью нажатия соответствующей кнопки-клапана необходимое кол-во водного раствора Vр (от 100 до 190 мл, синего цвета), добавить клапаном 4 жидкой органической фазы. После чего включить магнитную мешалку и перемешать растворы в течение 30 сек.

Рис. 8. Схема установки для разделения ионов меди между двумя несмешивающимися жидкостями: 1 – емкость для разделения (экстрактор), 2 – кнопка включения магнитной мешалки, трубки для подачи/слива: 3 – водного раствора содержащего ионы меди, 4 – органической фазы, 5 – на отбор проб для титрования, 6 – растворов в отстойник
Затем полученной эмульсии дают отстояться, и когда установятся два слоя, нижний (воду) в количестве 20 мл сливают нажатием на клапан трубки 5 в колбу для титрования 7 (Рис.9).
С помощью клапана 8 в бюретку 9 заливают титрующий раствор (водный раствор тиосульфата натрия) до выбранного уровня. К исследуемому раствору в колбе 7 добавляют 2 г KJ и 2 мл крахмала с помощью кнопки 10. При добавлении избытка KJ в исследуемый раствор вся медь содержащаяся в нем превращается в иодид и осаждается на дно сосуда.
|
2Cu 2+ +4I- = 2 CuI + I2 |
(47) |
В ходе этой реакции происходит выделение молекулярного йода J2 , который в присутствии крахмала придает раствору ярко синюю окраску.
Далее с помощью крана 11 начинают титрование, приливая титрующий раствор из бюретки в колбу 7. При этом осуществляется реакция:
|
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6. |
(48) |

Тиосульфат натрия взаимодействует с йодом, уменьшая его количество. В момент времени, когда весь молекулярный йод прореагирует по реакции (48), окраска раствора резко изменит свой цвет с синего на бесцветный. Как только раствор обесцветился титрование прекращают и фиксируют потраченное количество титрующего раствора Vт. Зная концентрацию тиосульфата натрия (Na2S2O3) в титрующем растворе, равную 0,1 моль/л, рассчитывают по реакциям (1 и 2) концентрацию меди в исследуемом растворе Ср1. В соответствии с реакцией (47) 2 моля прореагировавших ионов меди приходится 1 моль выделившегося иода. И по реакции (48) для нейтрализации 1 моля иода необходимо 2 моля тиосульфата натрия.
Рис. 9. Схема установки для титрования
7 – колба, 9 – бюретка, 10 – добавление KJ,
8,11, 12 – клапаны
То есть 1 моль прореагировавших Cu2+ приведет к затратам при титровании 1 моль Na2S2O3:
|
|
(49) |
Следовательно концентрацию Ср1 можно определить по формуле:
|
Ср1= 0,1*Vт/20. |
(50) |
При
выполнении работы на экране в правом
нижнем углу отображается начальная
концентрация ионов меди в растворе
подаваемом в экстрактор C0
от 0,01 до 0,05 моль/л. До процесса экстракции
водный раствор содержал количество
меди равное
![]() .
После того как произошло перераспределение,
в растворе остались ионы меди в количестве
.
После того как произошло перераспределение,
в растворе остались ионы меди в количестве
![]() .
Следовательно в органическую фазу
перешло количество меди равное
.
Следовательно в органическую фазу
перешло количество меди равное
![]() .
Зная перераспределившееся количество
меди, определяют равновесную концентрацию
меди в органической фазе Ср2.
.
Зная перераспределившееся количество
меди, определяют равновесную концентрацию
меди в органической фазе Ср2.
В емкости, где происходит разделение, остался раствор в количестве достаточном для повторного осуществления операции титрования. Поэтому клапаном 12 сливают из колбы 7 раствор после титрования и проводят химический анализ повторно. Определение концентрации меди в исследуемом растворе осуществляют 3 раза. По результатам трех измерений определяют средние значения концентраций.
Используя уравнение (46) находят коэффициент распределения ионов меди между водой и органической фазой для одной равновесной концентрации ионов меди в воде. Изменяя соотношения объемов органической фазы и водной (водный раствор добавляется в количестве 190, 180, 170, 160, 150 мл; органический до метки в 200 мл), изменяют равновесную концентрацию ионов меди. Определяют зависимость коэффициента распределения L от концентрации. Результаты измерения и расчетов помещают в таблицу 5.
Таблица 5
Результаты работы
|
№ опыта
|
Количество раствора тиосульфата, V, мл |
Концентрация, моль/л |
Коэффициент распределения L |
|||||
|
№ пробы |
Vср, мл |
С0 |
Ср1 |
Ср2 |
||||
|
1 |
2 |
3 |
||||||
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
Вопросы для самоконтроля
1. Что называют константой распределения; от каких факторов зависит константа распределения?
2. Что называют коэффициентом распределения; в каком случае коэффициент распределения не зависит от состава раствора?
3. Чему равно число степеней свободы системы, состоящей из двух несмешивающихся индивидуальных жидкостей и распределенного между ними третьего вещества?
4. В каком случае по результатам опытов можно говорить о независимости коэффициента распределения от состава раствора?
5. В условиях задачи требуется очистить изоамиловый спирт от уксусной кислоты при помощи 1 литра воды. Коэффициент распределения равен 1. Как выгоднее ее использовать для этой цели: залить ли ее всю в делительную воронку сразу или отдельными порциями?
6. Изменится ли коэффициент распределения, если между двумя несмешивающимися фазами поместить третью фазу?
7. В чем состоит практическое значение определения коэффициента распределения вещества в двух несмешивающихся жидкостях?
Работа № 5. ОПРЕДЕЛЕНИЕ ПАРЦИАЛЬНО-МОЛЯРНЫХ ОБЪЕМОВ КОМПОНЕНТОВ БИНАРНОГО РАСТВОРА
В данной работе изучается зависимость парциально-молярных объемов компонентов раствора "вода - этиловый спирт" от химического состава.
Подготовка к работе требует усвоения следующих разделов теоретического курса: понятие парциально-молярного свойства компонента раствора, уравнение Гиббса-Дюгема и следствия из него, идеальные растворы и причины отклонений от свойств идеальных растворов в реальных системах.
Теоретические сведения
Любое
экстенсивное свойство раствора при
фиксированных температуре и давлении
зависит от числа молей компонентов,
составляющих раствор. Так, для бинарного
раствора экстенсивное свойство
![]() является функцией внешних параметров
является функцией внешних параметров
![]() и чисел молей
и чисел молей
![]() ,
то есть
,
то есть
|
|
(51) |
Полный
дифференциал свойства может быть выражен
через частные производные и приращения
независимых переменных. Поэтому при
постоянных
![]() :
:
|
|
(52) |
Частную
производную экстенсивного свойства
раствора
![]() по числу молей данного компонента при
постоянных
по числу молей данного компонента при
постоянных
![]() и числах молей остальных компонентов
называют парциально-молярным
свойством
компонента. То есть парциально-молярное
свойство
и числах молей остальных компонентов
называют парциально-молярным
свойством
компонента. То есть парциально-молярное
свойство
![]() это
приращение общего молярного свойства
это
приращение общего молярного свойства
![]() раствора,
получающегося в результате добавления
в раствор заданного состава бесконечно
малого количества растворенного вещества
при p,
T
= const
и постоянном составе раствора,
пересчитанное на 1 моль растворенного
вещества:
раствора,
получающегося в результате добавления
в раствор заданного состава бесконечно
малого количества растворенного вещества
при p,
T
= const
и постоянном составе раствора,
пересчитанное на 1 моль растворенного
вещества:
|
|
(53) |
Представим уравнение (52) в виде
|
|
(54) |
или для многокомпонентного раствора:
|
|
(55) |
Парциально-молярные
свойства компонентов раствора зависят
от
![]() и химического состава, причем их изменения
взаимно связаны. Эта связь при
и химического состава, причем их изменения
взаимно связаны. Эта связь при
![]() устанавливается уравнением Гиббса-Дюгема
устанавливается уравнением Гиббса-Дюгема
|
|
(56) |
В случае бинарного раствора уравнение (55) может быть записано в форме
|
|
(57) |
Из
уравнения (57) следует, что приращения
свойств
![]() и
и
![]() противоположны
по знаку, то есть, если с увеличением
концентрации одного из компонентов его
парциально-молярное свойство растет,
то для другого оно обязательно уменьшается.
Анализ уравнения (57) показывает также,
что интенсивнее с составом раствора
меняется свойство компонента, концентрация
которого в растворе меньше.
противоположны
по знаку, то есть, если с увеличением
концентрации одного из компонентов его
парциально-молярное свойство растет,
то для другого оно обязательно уменьшается.
Анализ уравнения (57) показывает также,
что интенсивнее с составом раствора
меняется свойство компонента, концентрация
которого в растворе меньше.
В данной лабораторной работе исследуются парциально-молярные свойства раствора на примере определения парциально-молярных объемов компонентов бинарного раствора, то есть общее молярное свойство z – это молярный объем Vm. И применяя приведенные выше выражения для системы «вода-спирт» получим:
|
|
(58) |
Уравнение Гиббса-Дюгема для парциально-молярных объемов компонентов бинарного раствора:
|
|
(59) |
Поскольку любое свойство раствора складывается аддитивно из парциально-молярных свойств компонентов, то мольный объем бинарного раствора
|
|
(60) |
В
этом выражении
![]() - мольные доли компонентов, равные
отношению числа молей данного компонента
к общему числу молей всех компонентов
раствора.
- мольные доли компонентов, равные
отношению числа молей данного компонента
к общему числу молей всех компонентов
раствора.
Часто
для определения величин
![]() компонентов бинарного раствора
используют графический метод, требующий
знания зависимости мольного свойства
компонентов бинарного раствора
используют графический метод, требующий
знания зависимости мольного свойства
![]() от мольной доли одного из компонентов.
от мольной доли одного из компонентов.
Допустим, эта зависимость для молярного объема известна и представлена на рис. 10.
Докажем,
что отрезок Оа, отсекаемый касательной
AM, проведенной к кривой
![]() в точке М, численно равен парциально-молярному
объему первого компонента в растворе
состава
в точке М, численно равен парциально-молярному
объему первого компонента в растворе
состава
![]() .
.
Из
рисунка следует, что для любой выбранной
мольной доли второго компонента (![]() ),
в том числе и для
),
в том числе и для
![]() ,
справедливо равенство:
,
справедливо равенство:
|
|
(61) |
В бинарном растворе
|
|
(62) |
a
![]() ,
т.к.
,
т.к.
![]() .
.
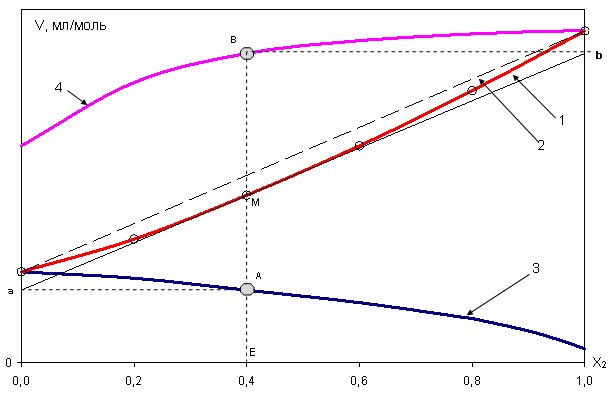
Рис. 10 – к определению парциально-молярных объемов раствора
Учитывая это обстоятельство и соотношение (57), запишем равенство (58) в виде:
|
|
(63) |
Таким
образом, отрезок Оа, отсекаемый касательной
на оси ординат при
![]() ,
равен парциально-молярному объему
первого компонента. Аналогично отрезок,
отсекаемый этой касательной аb
на оси ординат справа, то есть при
,
равен парциально-молярному объему
первого компонента. Аналогично отрезок,
отсекаемый этой касательной аb
на оси ординат справа, то есть при
![]() ,
соответствует величине
,
соответствует величине
![]() .
.
Кривая
![]() на рис. 10 проходит ниже аддитивной
прямой (пунктир), характерной для
идеальных растворов, где
на рис. 10 проходит ниже аддитивной
прямой (пунктир), характерной для
идеальных растворов, где
|
|
(64) |
Причиной
отклонения молярного объема реального
раствора от такового для идеального
является различие в энергиях связи
между различными частицами раствора.
Если энергия связи разноименных частиц
(
![]() ) больше средней энергии связи одноименных
(
) больше средней энергии связи одноименных
(![]() ),
то есть
),
то есть
|
|
(65) |
и образование раствора сопровождается его уплотнением.
Подобная зависимость характерна для растворов с отрицательными отклонениями от идеального раствора. При значительных различиях в энергиях связи парциально-молярный объём компонента может оказаться отрицательным, что говорит об уменьшении общего объема раствора при добавлении к нему данного компонента.
Порядок выполнения работы
Молярный объем раствора можно найти из очевидного соотношения
|
|
(66) |
в
котором
![]() – молярные массы компонентов раствора,
а
– молярные массы компонентов раствора,
а
![]() – плотность раствора.
– плотность раствора.
Плотность
раствора
![]() ,
необходимую для расчета молярного
объема
,
необходимую для расчета молярного
объема
![]() ,
можно определить методом взвешивания
металлического шарика последовательно
на воздухе, в чистой воде и в данном
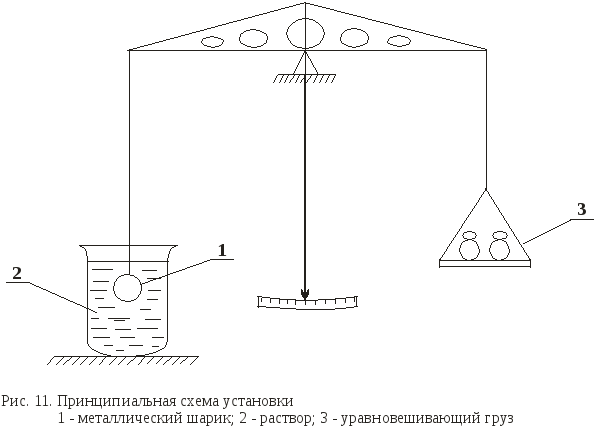
водном растворе. Для этой цели в работе
используются аналитические весы, к
одному из коромысел которых подвешен
металлический грузик (I) объемом около
1см3
(см. рис. 11).
,
можно определить методом взвешивания
металлического шарика последовательно
на воздухе, в чистой воде и в данном
водном растворе. Для этой цели в работе
используются аналитические весы, к
одному из коромысел которых подвешен
металлический грузик (I) объемом около
1см3
(см. рис. 11).
При
взвешивании, шарика объемом
![]() и плотностью
и плотностью
![]() ,
находящегося в какой-либо среде (воздух,
вода, раствор) плотностью
,
находящегося в какой-либо среде (воздух,
вода, раствор) плотностью
![]() ,
следует учесть выталкивающую силу
Архимеда
,
следует учесть выталкивающую силу
Архимеда
![]() ,
поэтому измеряемый вес в среде (
,
поэтому измеряемый вес в среде (![]() )
)
|
|
(67) |
Записывая
уравнение (64) для трех сред (воздух, вода
и раствор), получим систему трех уравнений
с тремя неизвестными величинами (![]() ).
Её решение дает следующую расчетную
формулу для плотности раствора:
).
Её решение дает следующую расчетную
формулу для плотности раствора:
|
|
(68) |
Поскольку плотность воздуха мала и составляет при нормальных условиях 0,0013 г/см3, а множитель, стоящий после нее в уравнении (65), значительно меньше единицы, то для практических расчетов целесообразно воспользоваться формулой
|
|
(69) |
Взвешивание шарика в растворе проводится три раза по схеме: колба №1, №2, №3, ... ; №1, №2, №3 ... ; №1, №2, №3 ... ; Результаты взвешивания вносят в табл. 6.
Таблица 6
Результаты взвешивания
|
x2 P |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
|
PI |
|
|
|
|
|
|
PII |
|
|
|
|
|
|
PIII |
|
|
|
|
|
|
|
|
|
|
|
|
По
результатам трех взвешиваний по формуле
(4) согласно пункту 2 на стр. 8 руководства
«Термодинамика» следует найти случайную
среднеквадратическую погрешность
определения молярного объема (![]() ),
затем определить относительную
погрешность измерения величин
),
затем определить относительную
погрешность измерения величин
![]() .
По этим данным оценить целесообразное
число значащих цифр в результате и
заполнить колонку
.
По этим данным оценить целесообразное
число значащих цифр в результате и
заполнить колонку
![]() табл. 7.
табл. 7.
Таблица 7
Результаты
определения величин
![]()
|
x2
V, м3/моль |
0 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Величину
![]() чистого этилового спирта необходимо
рассчитать по табличному значению
плотности
чистого этилового спирта необходимо
рассчитать по табличному значению
плотности
![]() ( t = 20 °С).
Затем, построив график зависимости
мольного объема раствора от состава,
определить графическим методом величины
( t = 20 °С).
Затем, построив график зависимости
мольного объема раствора от состава,
определить графическим методом величины
![]() ,
,
![]() и заполнить окончательно табл. 6.
Возможен и вариант машинного расчета
величин
и заполнить окончательно табл. 6.
Возможен и вариант машинного расчета
величин
![]() и
и
![]() по заранее составленной программе (по
усмотрению преподавателя).
по заранее составленной программе (по
усмотрению преподавателя).
Вопросы для самоконтроля
1.
Что называют парциально-молярной
величиной
![]() любого свойства компонента в растворе;
поясните физический смысл величины
любого свойства компонента в растворе;
поясните физический смысл величины
![]() ?
?
2. Запишите уравнение Гиббса-Дюгема и поясните физический смысл входящих в него величин.
3. Каким методом в работе определяют парциально-мольный объем компонентов?
4. Выше или ниже аддитивной прямой, характерной для идеальных растворов, пойдет зависимость мольного объема раствора, если смешение чистых жидких компонентов I и 2 происходит с выделением большого количества тепла?
5. Зависимость объема раствора, содержащего 50 молей воды и n2 молей растворенного вещества, передается уравнением:
|
|
|
Определите
парциально-молярный объем растворенного
вещества, мольный объем раствора и
величину
![]() ,
если раствор содержит один моль
растворенного вещества.
,
если раствор содержит один моль
растворенного вещества.
6.
При добавлении малых порций растворенного
вещества к растворителю мольный объем
раствора не изменяется. Чему равен
парциально-молярный объем растворенного
вещества, если
![]() =20
см3/моль,
а
=20
см3/моль,
а
![]() =12
см3/моль?
=12
см3/моль?
Работа № 6. ОПРЕДЕЛЕНИЕ КРИОСКОПИЧЕСКОЙ ПОСТОЯННОЙ ВОДЫ
Целью работы является определение криоскопической постоянной воды по температуре начала кристаллизации разбавленных водных растворов некоторых нелетучих органических веществ (глюкоза, сахароза, мочевина и др.).
Выполнение работы требует предварительного изучения теории идеальных и разбавленных растворов, знания правила фаз Гиббса.
Теоретические сведения
Равновесная
кристаллизация индивидуальных жидкостей
происходит при строго фиксированной
температуре (T1),
зависящей от внешнего давления. Принято
называть нормальной температурой
плавления (кристаллизации) вещества
температуру при равновесии жидкой и
твердой фаз под давлением в
![]() (I атм). По правилу фаз Гиббса число
степеней свободы двухфазной однокомпонентной
системы при фиксированном давлении
равно нулю. Это означает, что в процессе
обратимой кристаллизации температура
остается постоянной до тех пор, пока в
системе присутствует жидкая фаза.
(I атм). По правилу фаз Гиббса число
степеней свободы двухфазной однокомпонентной
системы при фиксированном давлении
равно нулю. Это означает, что в процессе
обратимой кристаллизации температура
остается постоянной до тех пор, пока в
системе присутствует жидкая фаза.
Растворы,
как правило, кристаллизуются в некотором
интервале температур. Температура, при
которой из раствора выпадают первые
кристаллы твердой фазы, называется
температурой начала кристаллизации
(Т).
В случае, когда из раствора при постоянном
давлении выпадают кристаллы чистого
растворителя, из двух переменных
(температура и концентрация растворителя
в жидком растворе x1)
произвольно при
![]() можно варьировать лишь одну, так как
число степеней свободы системы равно
единице:
можно варьировать лишь одну, так как
число степеней свободы системы равно
единице:
|
|
(70) |
Для идеальных растворов температура начала кристаллизации Т связана с составом раствора уравнением:
|
|
(71) |
В
этом соотношении
![]() и T1
– мольная теплота и температура плавления
чистого растворителя соответственно.
и T1
– мольная теплота и температура плавления
чистого растворителя соответственно.
Разность между температурами плавления чистого растворителя и начала кристаллизации раствора называют понижением температуры кристаллизации. Согласно (1) эта величина
|
|
(72) |
Уравнение
(71) может быть применено к растворителю
в бесконечно разбавленном растворе,
поскольку по отношению к нему раствор
является идеальным. Кроме того, это
равенство может быть упрощено.
Действительно, в разбавленном растворе
мольная доля растворенного вещества
«2»
![]() ,
поэтому
,
поэтому
|
|
(73) |
В
разбавленных растворах химический
состав удобнее характеризовать величиной
моляльности m
, т.е. числом молей растворенного вещества
в 1000 г растворителя. Если раствор
приготовлен из g1
граммов растворителя с молярной массой
М1
и g2
граммов растворенного вещества с
молярной массой M2,
то число молей компонента 2, приходящихся
на I грамм растворителя, составит
![]() молей. Моляльность такого раствора
определяется равенством:
молей. Моляльность такого раствора
определяется равенством:
|
|
(74) |
Выразим
мольную долю компонента 2 через моляльность
раствора. Так как в рассматриваемом
растворе
![]() ,
то
,
то
|
|
(75) |
Таким образом, с учетом (73) и (75) уравнение (72) принимает вид:
|
|
(76) |
Величину
|
|
(77) |
называют криоскопической постоянной растворителя, она зависит лишь от его природы и не зависит от концентрации и природы растворенного вещества. Согласно (76) понижение температуры кристаллизации разбавленного раствора прямо пропорционально числу растворенных частиц в 1000 г растворителя. Поэтому величина ΔT при заданной моляльности раствора будет зависеть и от степени диссоциации растворенного вещества.
Порядок выполнения работы
Понижение температуры кристаллизации раствора определяют с помощью установки, схема которой приведена на рис. 12.
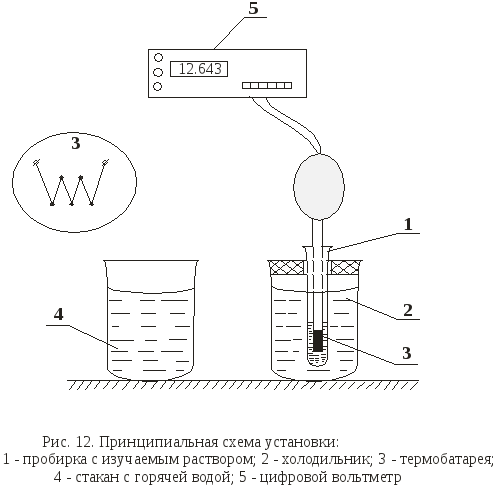
Пробирку 1 с исследуемым раствором необходимо поместить в холодильник 2 и ввести в раствор «рабочий» конец термобатареи 3. Термобатарея представляет собой несколько последовательно включенных дифференциальных термопар (более 10 штук), которые многократно усиливают сигнал, получаемый от исследуемой системы. Другой конец термобатареи находится при комнатной температуре. В этом случае электрический сигнал с термобатареи характеризует температуру охлаждения раствора от времени. Типичный вид кривой охлаждения приведен на рис. 13.
Tемпературой начала кристаллизации раствора следует считать наивысшую температуру tнк (рис. 13), полученную после переохлаждения. Для ее точного определения следует внимательно следить за показаниями цифрового вольтметра 5. В области переохлаждения из раствора начинают выпадать кристаллы. Этот процесс сопровождается выделением тепла, а следовательно, повышением температуры до значения температуры начала кристаллизации (точка tнк на рис.13, кривая б). Таким образом, показания вольтметра сначала уменьшаются, (по абсолютному значению увеличиваются, так как измерение проходит в области температур пониженных относительно комнатной), затем увеличиваются до температуры начала кристаллизации, после чего снова уменьшаются – кривая б на рис. 13. Температуру кристаллизации растворителя определяют не менее трех раз. Для нагрева исследуемого раствора до исходной температуры используют стакан с горячей водой 4. Результаты измерений заносят в табл. 8.

Таблица 8
Экспериментальные данные
|
№ опыта |
Концентрация растворенного вещества, мас. % |
Моляльная концентрация раствора (mi), моль/кг |
Температура кристаллизации растворителя
|
Понижение температуры кристаллизации
|
|||
|
1 |
2 |
3 |
среднее
|
||||
|
1 2 … n |
|
|
|
|
|
|
|
Понижение
температуры замерзания находят как
разницу между температурой кристаллизации
чистого растворителя (![]() )
и температурой кристаллизации растворителя
из раствора (
)
и температурой кристаллизации растворителя
из раствора (![]() ).
).
По
данным табл. 8 строят график зависимости
понижения температуры кристаллизации
растворителя от моляльной концентрации
раствора. Угловой коэффициент полученной
прямой определяет опытное значение
криоскопической постоянной (![]() ).
Его можно рассчитать по формуле
).
Его можно рассчитать по формуле
|
|
(78) |
где
![]() – значения понижения температуры
кристаллизации растворителя и моляльность
раствора в i-м
опыте соответственно.
– значения понижения температуры
кристаллизации растворителя и моляльность
раствора в i-м
опыте соответственно.
Данная
формула получена методом наименьших
квадратов из условия: сумма квадратов
отклонений экспериментальных точек от
прямой, проходящей через начало координат
и имеющей угловой коэффициент, равный
![]() ,
должна быть минимальной. Для расчета
,
должна быть минимальной. Для расчета
![]() следует заполнить табл. 9.
следует заполнить табл. 9.
Таблица 9
К расчету опытного значения криоскопической постоянной
|
№ опыта |
K |
моль/кг |
моль2/кг2 |
мольК/кг |
К2 |
|
1 2 … n |
|
|
|
|
|
Случайную
погрешность величины
![]() ,
найденной методом наименьших квадратов,
рассчитывают по формуле
,
найденной методом наименьших квадратов,
рассчитывают по формуле
|
|
(79) |
Опытное
значение криоскопической постоянной
сравнивают с рассчитанным по уравнению
(78). Если разница между
![]() и
и
![]() не превосходит
не превосходит
![]() ,
то можно пренебречь систематической
погрешностью. В противном случае следует
оценить систематическую погрешность
δ:
,
то можно пренебречь систематической
погрешностью. В противном случае следует
оценить систематическую погрешность
δ:
|
|
(80) |
и
по формуле (6), приведенной в третьей
части «Руководства», определить суммарную
погрешность
![]() .
.
Затем требуется оценить целесообразное число значащих цифр в записи результатов измерений и представить результат с указанием погрешности.
Контрольные вопросы
1. Чему равно число степеней свободы при равновесии жидкого раствора с чистым твердым растворителем?
2. Чем определяется величина изменения температуры кристаллизации ΔТ?
3. Для каких растворов наблюдается линейная связь понижения температуры кристаллизации с моляльностью?
4. Каким образом природа растворенного вещества может повлиять на величину изменения температуры кристаллизации?
5. Как измерить температуру кристаллизации в данной работе?
6. От каких факторов зависит криоскопическая постоянная; от каких факторов криоскопическая постоянная не зависит?
ПРИЛОЖЕНИЕ 1. Термодинамические свойства некоторых веществ
|
Вещество |
|
|
|
||
|
|
|
|
|||
|
СО2 газ |
393,51 |
213,66 |
44,14 |
9.04 |
-8,79 |
|
СО газ |
110,53 |
197,55 |
28,41 |
4,10 |
-0,46 |
|
С граф |
0 |
5,74 |
16,86 |
4,77 |
-8,54 |
|
СаО тв |
635,09 |
38,07 |
49,62 |
4,52 |
-6,95 |
|
СаСО3 тв |
1206,83 |
91,71 |
104,52 |
21,92 |
-25,94 |
ПРИЛОЖЕНИЕ
2. Расчет величины
![]() в работах №1 и №2
в работах №1 и №2
Среднюю
величину теплового эффекта реакции в
изученном интервале температур (![]() )
можно оценить по опытным значениям
константы равновесия при разных
температурах. Для этого необходимо
проинтегрировать уравнение изобары
химической реакции, считая
)
можно оценить по опытным значениям
константы равновесия при разных
температурах. Для этого необходимо
проинтегрировать уравнение изобары
химической реакции, считая
![]() постоянным:
постоянным:
![]() ,
,
после интегрирования получим
![]()
где
![]() – постоянная интегрирования. Из данного
соотношения следует, что опытные данные,
представленные в координатах «
– постоянная интегрирования. Из данного
соотношения следует, что опытные данные,
представленные в координатах «![]() »,
должны располагаться около прямой
линии, угловой коэффициент которой
»,
должны располагаться около прямой
линии, угловой коэффициент которой
![]() равен
равен
![]() .
.
Следовательно,
![]()
При нахождении углового коэффициента
необходимо учесть, что масштаб оси
абсцисс и оси ординат различен. Поэтому
![]() следует находить как отношение катетов
прямоугольного треугольника, длины
которых выражены в единицах соответствующих
осей.
следует находить как отношение катетов
прямоугольного треугольника, длины
которых выражены в единицах соответствующих
осей.
Таким образом,
ПРИЛОЖЕНИЕ 3. Интегральные теплоты растворения некоторых солей в воде при 25ºС
|
Соль |
KI |
NH4Cl |
KCl |
NaCl |
|
|
20,59 |
15,23 |
17,55 |
4,25 |
Библиографический список
-
Жуховицкий А.А. Физическая химия / А.А. Жуховицкий, Л.А, Шварцман. М.: Металлургия, 2001. 688с.
-
Стромберг А.Г. Физическая химия / А.Г. Стромберг, Д.П. Семченко. М.: Высшая школа, 1988. 496 с.
-
Карапетьянц М.Х. Химическая термодинамика / М.Х. Карапетьянц, М.: Химия, 1985. 580 с.
-
Краткий справочник физико-химических величин/ Под ред. А.А. Равделя и А.М. Пономаревой. СПб: Медный всадник, 2003. 240 с.
-
Зайдель А.Н. Погрешности измерений физических величин. Л.: Наука, 1985. 112 с.

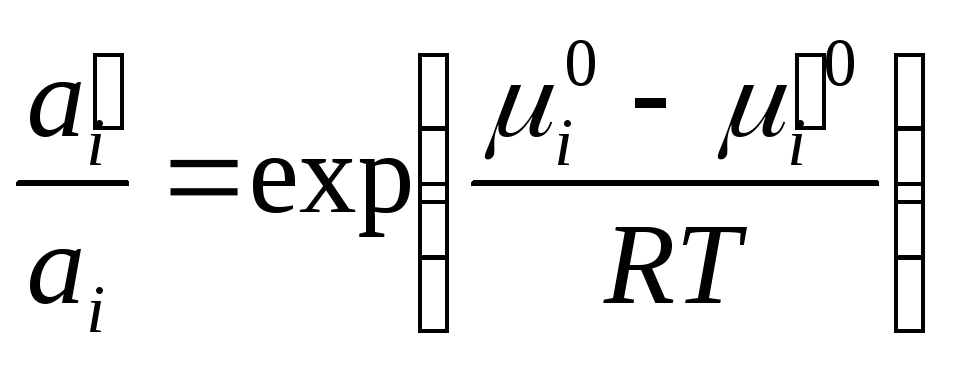 .
.