- •Кафедра химии
- •Лабораторная работа № 1
- •1.1 Теоретические основы метода
- •1.3 Приборы и реактивы:
- •1.4 Химические основы фотометрического определения меди в виде аммиачных комплексов
- •1.5 Порядок выполнения работы
- •1.6 Обработка полученных результатов
- •1.7 Результаты работы
- •Лабораторная работа № 2 Определение содержания сульфат-ионов методом турбидиметрии
- •2.1 Теоретические основы метода
- •2.4 Химические основы турбидиметрического определения ионов so42–
- •2.5 Порядок выполнения работы
- •2.6 Результаты работы
- •Список литературы
- •Вопросы к защите лабораторных работ
- •Уметь решать следующие задачи:
2.4 Химические основы турбидиметрического определения ионов so42–
Определение основано на образовании труднорастворимого осадка сульфата бария при взаимодействии сульфат-ионов с ионами бария:
Ba2+ + SO42– → BaSO4↓
В разбавленных растворах сульфатов выпадение осадка происходит медленно и образуется устойчивая во времени суспензия. Суспензию стабилизируют прибавлением крахмала или желатина. Для обеспечения избирательного осаждения сульфатов относительно карбонатов, фосфатов и оксалатов реакцию проводят в кислой среде.
2.5 Порядок выполнения работы
2.5.1 Построение калибровочного графика
1) В мерные колбы на 50 мл с помощью градуированной пипетки вносят 0.2, 0.4, 0.6, 0.8, 1.0 мл стандартного раствора CaSO4. В каждую колбу добавляют цилиндром 1 мл HCl (1:4), 2 мл желатина или крахмала и перемешивают. Затем приливают 5 мл (отмеряют цилиндром) 5% раствора ВaСl2 и доводят дистиллированной водой до метки.
-
Поверяют настройку прибора на «0» и «100» по дистиллированной воде.
3) Растворы, начиная с самого разбавленного, заливают в кювету и измеряют величину светопропускания Т по шкале прибора.
4) Вычисляют оптическую плотность по формуле:
D = –lg T (в долях).
5) Рассчитывают концентрацию приготовленных растворов:
Масса вещества, содержащаяся в заданном объеме стандартного вещества, будет равна массе вещества в приготовленном разбавленном растворе. В данном случае используется концентрация выражается в единицах г/л и, рассчитывается по формуле:
![]() ,
отсюда m(в-ва)
= Ср
· Vр
= Ск
· Vк.
6
,
отсюда m(в-ва)
= Ср
· Vр
= Ск
· Vк.
6
где Ср и Vр – концентрация и объем разбавленного раствора, а Ск и Vк – концентрация и объем концентрированного раствора.
Выразим концентрацию полученного разбавленного раствора:
|
|
для первого раствора концентрация равна: |
|
|
Для остальных растворов проводят аналогичные расчеты. Все полученные значения концентрации растворов и оптической плотности заносят в таблицу 4: |
||
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Таблица 4 – Зависимость оптической плотности раствора от концентрации сульфат-ионов
|
V(CaSO4) мл |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
С (CaSO4), г/л |
|
|
|
|
|
|
Т |
|
|
|
|
|
|
D |
|
|
|
|
|
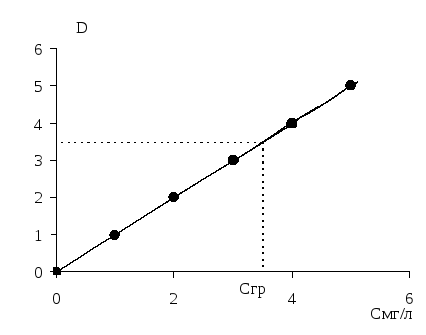
По полученным значениям на миллиметровой бумаге строят калибровочный график (рисунок 5) в координатах оптическая плотность D по оси y и концентрация (С, г/л) по оси х. Получают прямую линию, выходящую из нуля. Если линия не выходит из нуля, необходимо приготовить раствор сравнения, в состав которого входят все компоненты, кроме сульфата кальция. Для этого раствора измеряют коэффициент светопропускания Т и рассчитывают оптическую плотность. В таком случае график будет выходить из точки, соответствующей оптической плотности раствора сравнения.
|
|
|
Рисунок 5 – Калибровочный график |
2.5.2 Определение неизвестной концентрации сульфат-ионов
Полученный раствор задачи доводят до метки дистиллированной водой в колбе на 100 мл. Затем в колбу на 50 мл отбирают пипеткой аликвотную часть задачи (1–3 мл), добавляют цилиндром 1 мл HCl, 2 мл желатина, 5 мл 5% раствора ВaСl2 и доводят раствор до метки дистиллированной водой. Определив по шкале прибора величину Т, вычисляют оптическую плотность D, по графику находят соответствующую концентрацию (Сгр).
Концентрацию анализируемого раствора СХ вычисляют по формуле:
![]() ,
,
где VК – объем колбы с задачей (100 мл), Vпип – объем пипетки.
1._____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2._____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3._____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________