
- •Общие методические указания
- •Контрольные задания
- •Teма 1. Основные понятия и законы химии.
- •Тема 2. Строение атома. Периодический закон и периодическая система элементов д.И.Менделеева.
- •Тема 3. Химическая связь и строение молекул.
- •Тема 4. Химическая кинетика и равновесие.
- •Тема 5. Энергетика химических процессов.
- •Тема 6. Концентрации растворов и способы их выражения.
- •Тема 7. Ионные реакции обмена
- •Тема 8. Гидролиз солей.
- •Тема 9. Гетерогенные равновесия. Произведение растворимости
- •Тема 10. Окислительно-восстановительные реакции
- •Тема 11. Электродные потенциалы и электродвижущие силы
- •Тема 12. Электролиз
- •Тема 13. Коррозия металлов
- •Тема 14. Полимеры
- •Рекомендуемая литература
- •Приложение Вопросы, предлагаемые студентам нф специальности «Разработка и эксплуатация нефтяных и газовых месторождений» для подготовки к экзамену по химии
Тема 3. Химическая связь и строение молекул.
-
Какую химическую связь называют ионной? Как она образуется и какими свойствами обладает? На основе разности относительных электроотрицательностей атомов элементов укажите, как изменяется степень ионности в соединениях HF, HCl, HBr, HI.
-
Какой тип связи осуществляется в кристаллах металлов? Каковы особенности этого типа связи?
-
В каком из приведенных соединений: LiF, BeF2, BF3, CF4 - связь Э-F будет больше всего приближаться к ковалентной?
-
Какую ковалентную связь называют -, -, -связью? Как метод ВС объясняет строение молекулы азота?
-
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей объясняет строение молекулы воды?
-
Сравните способы образования ковалентных связей в молекуле NH3 и в ионе NH4+.
-
Молекула BF3 имеет плоскостную структуру, а NF3 – объемную (пирамидальную). В чем причина различия в строении молекул?
-
Почему молекула CF4 имеет тетраэдрическую, ВF3 – треугольную, a BeCl2 – линейную формы? Каково гибридное состояние валентных орбиталей атома углерода в данных молекулах?
-
Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы каких из веществ: алмаз, хлорид натрия, диоксид углерода, цинк – имеют указанными структуры?
-
Составьте электронные схемы строение молекул хлора, сероводорода, тетрахлорметана. В каких молекулах ковалентная связь является полярной? Как метод валентных связей объясняет угловое строение молекулы сероводорода?
-
Какие силы молекулярного взаимодействия называются ориентационными, индукционными и дисперсионными? Когда возникают и какова природа этих сил?
-
Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса [Сu(NH3)4]2+. Укажите донор и акцептор.
-
Какая химическая связь называется водородной? Между молекулами каких веществ она образуется? Почему вода и фтороводород, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
-
Чем отличается структура кристаллов хлорид натрия от структуры кристаллов натрия? Какой вид связи осуществляется в этих кристаллах? Какие кристаллические решетки имеют натрий и хлорид натрия? Чему равно координационное число натрия в этих кристаллах?
-
Какая ковалентная связь называется полярной и неполярной? Что служит мерой полярности ковалентной связи? Составьте электронные схемы строения молекул азота, воды и йодоводорода. Какие из них являются диполями?
Тема 4. Химическая кинетика и равновесие.
-
Две реакции при 283 К протекают с одинаковой скоростью. Температурный коэффициент скорости первой и второй реакции равны соответственно 2,5 и 3,0. Как будут относится скорости реакций, если первую из них провести при 350 К, а вторую при 330 К? Ответ: 2,65 : 1,00.
-
В начальный момент протекания реакции N2 + 3H2
 2NH3
концентрации были равны (моль/л): азота
- 1,5; водорода - 2,5; аммиака - 0. Каковы
концентрации азота и водорода при
концентрации аммиака равной 0,5 моль/л?
Ответ: 1,25 моль/л; 1,75 моль/л.
2NH3
концентрации были равны (моль/л): азота
- 1,5; водорода - 2,5; аммиака - 0. Каковы
концентрации азота и водорода при
концентрации аммиака равной 0,5 моль/л?
Ответ: 1,25 моль/л; 1,75 моль/л. -
Начальные концентрации веществ в реакции СО + Н2О
 СО2
+ Н2
были равны (моль/л): С(СО) = 0,05; С(Н2Огаз)
= 0,06; С(СО2)
= 0,4; С(Н2)
= 0,2. Вычислите концентрации всех
реагирующих веществ после того, как
прореагировало 60 % Н2О.
Ответ: 0,24 моль/л; 0,14 моль/л; 0,76 моль/л;
0,56 моль/л.
СО2
+ Н2
были равны (моль/л): С(СО) = 0,05; С(Н2Огаз)
= 0,06; С(СО2)
= 0,4; С(Н2)
= 0,2. Вычислите концентрации всех
реагирующих веществ после того, как
прореагировало 60 % Н2О.
Ответ: 0,24 моль/л; 0,14 моль/л; 0,76 моль/л;
0,56 моль/л. -
Реакция идет по уравнению 4NH3 + 5O2
 4NO + 6H2O.
Как изменится скорость реакции, если
увеличить давление в 2 раза? Ответ:
возрастет в 512 раз.
4NO + 6H2O.
Как изменится скорость реакции, если
увеличить давление в 2 раза? Ответ:
возрастет в 512 раз. -
Реакция протекает по уравнению Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S. Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза? Ответ: уменьшится в 16 раз.
-
Вычислите при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент равен 3,2. Ответ:304,9 К.
-
На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: 45,30 C.
-
Определите равновесную концентрацию водорода в реакции
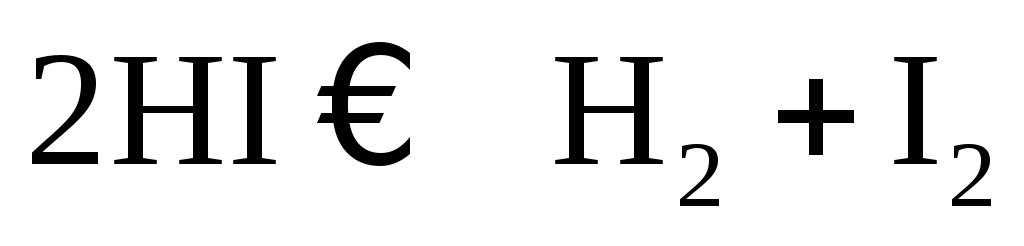 ,
если исходная концентрация HI составляет
0,55 моль/л, а константа равновесия равна
0,12. Ответ: 0,11 моль/л.
,
если исходная концентрация HI составляет
0,55 моль/л, а константа равновесия равна
0,12. Ответ: 0,11 моль/л. -
При синтезе фосгена имеет место равновесие реакции Сl2 + CO
 COCl2.
COCl2.
Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации в моль/л равны: [Cl2] = 2,5; [CO] = 1,8; [COCl2] = 3,2. Ответ: 5,0; 5,7 моль/л.
-
Реакция протекает по уравнению 2А
 В. Исходная концентрация вещества А
равна 0,2 моль/л. Константа равновесия
реакции 0,5. Вычислите равновесные
концентрации реагирующих веществ.
Ответ: 0,015 и 0,17 моль/л.
В. Исходная концентрация вещества А
равна 0,2 моль/л. Константа равновесия
реакции 0,5. Вычислите равновесные
концентрации реагирующих веществ.
Ответ: 0,015 и 0,17 моль/л. -
В каком направлении сместится равновесие реакции 2СО + 2Н2
 СН4
+ СО2,
если концентрации всех реагирующих
веществ уменьшить в 3 раза?
СН4
+ СО2,
если концентрации всех реагирующих
веществ уменьшить в 3 раза? -
Равновесие в системе 2 NO2
 2NO + O2
при некоторой температуре установилось
при концентрациях в моль/л: [NO2] = 0,06; [NO]
=0,24; [O2]
= 0,12. Определите константу равновесия
и рассчитайте исходную концентрацию
NO2. Ответ: 1,92; 0,3 моль/л.
2NO + O2
при некоторой температуре установилось
при концентрациях в моль/л: [NO2] = 0,06; [NO]
=0,24; [O2]
= 0,12. Определите константу равновесия
и рассчитайте исходную концентрацию
NO2. Ответ: 1,92; 0,3 моль/л. -
Определите равновесные количества веществ в реакции СО2 + Н2
 СО + Н2О(газ),
если константа равновесия при некоторой
температуре равна 1 и для реакции было
взято 1 моль углекислого газа и 3 моль
водорода. Ответ: [H2]
= 2,25; [CO2]
= 0,25; [CO] = 0,75; [H2O]
= 0,75 моль/л.
СО + Н2О(газ),
если константа равновесия при некоторой
температуре равна 1 и для реакции было
взято 1 моль углекислого газа и 3 моль
водорода. Ответ: [H2]
= 2,25; [CO2]
= 0,25; [CO] = 0,75; [H2O]
= 0,75 моль/л. -
При некоторой температуре константа равновесия реакции Н2+ Вr2
 2НВr равна 1. Определите состав равновесной
смеси, если для реакции были взяты 1
моль водорода и 2 моль брома. Ответ:
С(Н2)
= 0,55 моль. С (Вr2)
= 1,55 моль. С (НВr) = 0,90 моль.
2НВr равна 1. Определите состав равновесной
смеси, если для реакции были взяты 1
моль водорода и 2 моль брома. Ответ:
С(Н2)
= 0,55 моль. С (Вr2)
= 1,55 моль. С (НВr) = 0,90 моль. -
Для практической остановки реакции применяют быстрое охлаждение реакционной смеси. Определите, во сколько раз изменится скорость реакции при охлаждении реакционной смеси с 40 до -10 градусов Цельсия, если температурный коэффициент реакции равен 2.7. Ответ: в 143,5 раза.
