- •11. Модели ядер атомов Общие сведения о ядрах атомов
- •11.1. Структура ядра атома водорода
- •11.2. Структура ядра атома гелия
- •11.3. Структура ядра атома лития
- •11.4. Структура ядра атома бериллия
- •11.5. Структура ядра атома бора
- •11.6. Структура ядра атома углерода
- •11.7. Структура ядра атома азота
- •11.8. Структура ядра атома кислорода
- •11.9. Структура ядра атома фтора
- •10.10. Структура ядра атома неона
- •11.11. Структура ядра атома натрия
- •11.12. Структура ядра атома магния
- •11.13. Структура ядра атома алюминия
- •11.14. Структура ядра атома кремния
- •11.15. Структура ядра атома фосфора
- •11.16. Структура ядра атома серы
- •11.17. Структура ядра атома хлора
- •11.18. Структура ядра атома аргона
- •11.19. Структура ядра атома калия
- •10.20. Структура ядра атома кальция
- •11.21. Структура ядра атома скандия
- •11.22. Структура ядра атома титана
- •11.23. Структура ядра атома ванадия
- •11.24. Структура ядра атома хрома
- •11.25. Структура ядра атома марганца
- •11.26. Структура ядра атома железа
- •11.27. Структура ядра атома кобальта
- •11.28. Структура ядра атома никеля
- •11.29. Структура ядра атома меди
- •11.30. Анализ процессов синтеза атомов и ядер
- •11.31. Краткие выводы
- •12. Модели атомов и молекул
- •12.1. Структура атома водорода
- •12.2. Элементы молекулярной спектроскопии и молекулы водорода
- •12.3. Структура атома гелия
- •12.4. Структура атома лития
- •12.5. Структура атома бериллия
- •12.6. Структура атома бора
- •12.7. Структура атома углерода
- •12.8. Структура атома и молекулы азота
- •12.9. Структура атома и молекулы кислорода
- •12.10. Молекула озона и энергетика её химических связей
- •12.11. Структуры молекул и
- •12.12. Структура молекулы воды и её ионов
- •12.13. Энергетический баланс процессов синтеза молекул кислорода, водорода и воды
- •12.14. Кластеры воды и их энергии связи
- •Заключение
- •12.15. Молекула и кластеры бензола
- •13. Термодинамика микромира
- •13.1. Вводная часть
- •13.2. Закон излучения абсолютно черного тела – закон классической физики
- •Теоретическая часть
- •Если задаться вопросом: почему фотоны всех частот движутся в вакууме с одинаковой скоростью? То получается следующий ответ.
- •Классический вывод закона излучения абсолютно черного тела
- •13.3. Физический смысл тепла и температуры
- •13.4. Температура плазмы
- •13.5. Различия термодинамик макро – и микромира
- •Заключение
12.6. Структура атома бора
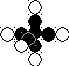
Атом бора - пятый элемент в таблице Менделеева. Большинство ядер этого атома имеет пять протонов и шесть нейтронов (рис. 50, b) [270].
|
ядро |
АТОМ |
Рис. 92. Ядро и атом бора
Ядро атома бора имеет одну ось симметрии. Аналогичную структуру имеет и атом этого химического элемента (рис. 92). Пять протонов имеют свободные магнитные полюса, к которым присоединяются электроны.
Ось первого электрона, проходящая через ядро атома, является единственной осью его симметрии. Дальше мы увидим, что более сложные атомы имеют несколько осей симметрии.
12.7. Структура атома углерода
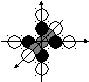
Углерод считается основой жизни, так как формирует наибольшее количество связей с атомами других химических элементов (рис. 93). Посмотрим на причину такой его активности. Ядро атома углерода имеет две формы.
|
Ядро атома графита |
Ядро атома алмаза |
|
Атом графита |
Атом алмаза |
Рис. 93. Плоская а) и пространственная b) структуры атома углерода:
N – ядро; e – электроны; XYZ – оси декартовой системы координат
Первая форма ядра, в которое входит шесть нейтронов, формирует атомы графита (рис. 51, а). Вторая, пространственная форма ядра может иметь семь или пять нейтронов. Она формирует ядра алмаза (рис. 51, b). Каждый протон имеет свободный магнитный полюс для соединения с электроном [270].
Все шесть протонов ядра атома углерода и все шесть его электронов имеют равные возможности вступать в связь с электронами других атомов и формировать сложные соединения. Атомы углерода с плоским ядром (рис. 93, а) формируют органические соединения, в которых все шесть электронов этого атома участвуют в формировании связей между атомами различных молекул.
Структура атома алмаза, которая формируется из пространственного ядра этого атома, имеет три оси симметрии (рис. 93, b). Это - оси декартовой системы координат. Структура пространственного ядра и атома углерода, и самого атома убедительно демонстрируют главное свойство алмаза – его прочность.
12.8. Структура атома и молекулы азота
Термин «азот» предложил Лавуазье. Он означает «безжизненный». Воздух содержит 75,6% азота по массе и около 23% кислорода. Но азот не поддерживает ни горение, ни дыхание. Молекулярный азот не соединяется с кислородом и это спасает всё живое Земли от формирования кислот в воздушной и водной средах.
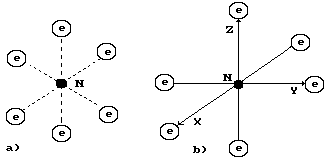
Азот – седьмой элемент в периодической таблице химических элементов, расположенный в её пятой группе. Структура его ядра показана на рис. 94, а. Она близка по форме к структуре ядра атома углерода. Поскольку большинство ядер атомов азота имеют семь протонов и семь нейтронов, то это большинство имеет плоские ядра, показанные на рис. 94, а [270].
Схема атома азота, имеющего такое ядро, показана на рис. 94, b. Атом азота имеет лишь один активный (валентный) осевой электрон. Именно эта особенность создаёт условия для формирования молекулы из двух атомов со столь большой энергией связи, что химики придумали для неё название тройной связи. Нет, связь у молекулы азота одна, но с большой энергией связи. Жаль, что спектр атома азота смешан со спектром его молекулы. Приводимая в справочниках по спектроскопии энергия ионизации атома азота, равная 14,534 eV, скорее всего, является энергией диссоциации молекулы азота, а не энергией ионизации его атома. Это достаточно большая энергия связи.
А теперь представим процесс перехода шести кольцевых электронов атома азота на нижние энергетические уровни. Его особенность заключается в том, что эти электроны переходят на нижние энергетические уровни одновременно, излучая при этом фотоны, размеры которых на несколько порядков больше размера атома азота. Когда в этот процесс вовлекается вся совокупность атомов азота вещества, в которое он входит, и когда в него вовлекаются атомы углерода и кислорода, которые также имеют кольцевую совокупность электронов, то суммарное количество излученных фотонов сразу увеличивает объём, занимаемый ими в пространстве, что и формирует явление взрыва.
|
a) Ядро атома азота |
b) Атом азота |
Рис. 94. Схема атома азота: N
– ядро атома;
![]() –
электроны атома
–
электроны атома
Конечно, существующее представление о том, что взрыв – расширение газов – глубоко ошибочно. Давление формируют одновременно излучаемые фотоны благодаря тому, что их размеры на 5-7 порядков больше размеров атомов. Из этого сразу вытекают неизвестные специалистам требования к взрывчатым веществам и ракетному топливу и методы их реализации, но мы не будем развивать эту тему по известным причинам.
При анализе структуры молекулы воды мы увидим причину увеличения её размера при замерзании. В этом процессе также участвуют кольцевые электроны и фотоны, излучаемые и поглощаемые ими, и мы наглядно увидим, как они реализуют его.
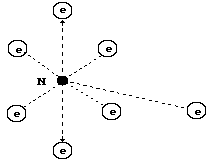
Молекулу азота (рис. 95) формируют электронные связи осевых электронов 1 и 2 его атомов. Связь оказывается достаточно прочной. Все остальные 12 электронов находятся на одинаковых расстояниях от ядер своих атомов и поэтому не могут быть активными, когда азот - в молекулярном состоянии. Нет электронов слева и справа от кольцевых электронов атомов вдоль оси симметрии молекулы. Это - главная причина низкой химической активности молекулы азота.
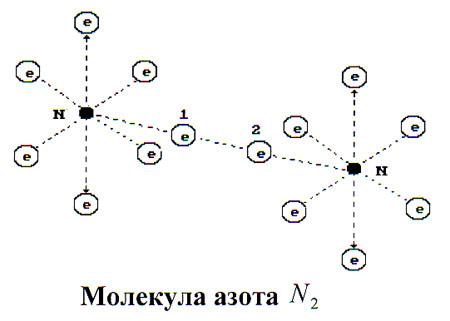
Рис. 95. Молекула азота
Вся энергия связи распределяется вдоль оси симметрии молекулы лишь между двумя электронами 1 и 2 (рис. 95), поэтому она названа химиками тройной связью. Теперь придётся отказываться от противоречивых представлений о молекулярных связях и привыкать к тому, что одна электрон - электронная связь в различных молекулах имеет разную величину энергии связи, которая и определяет активность молекулы при формировании различных соединений.