
- •1. Переваривание и всасывание нуклеопротеидов
- •2. Метаболизм пуриновых и пиримидиновых нуклеотидов
- •Катаболизм пуриновых нуклеотидов
- •Реакции распада мочевой кислоты. От нуклеотидов к основаниям.
- •Катаболизм пиримидиновых нуклеотидов
- •Продукты распада нуклеотидов могут повторно использоваться (реутилизацироваться)
- •De novo синтез пуриновых и пиримидиновых рибонуклеотидов
- •De Novo синтез пуриновых нуклеотидов.
- •Регуляция синтеза пуриновых нуклеотидов de novo
- •Cинтез пиримидиновых нуклеотидов de novo
- •Рибонуклеотидредуктаза и биосинтез дезоксирибонуклеотидов
- •Регуляция активности рибонуклеотид редуктазы
- •Биосинтез тимидиловых дезоксирибонуклеотидов
- •Обмен дезоксиуридиловых нуклеотидов
- •Наиболее частые проявления нарушений обмена пуринов - гиперурикемия и подагра
- •Нарушение обмена пиримидиновых нуклеотидов также приводит к болезням.
- •Биосинтез днк – один из важнейших процессов передачи генетической информации последующим поколениям и ее хранения.
- •Ретровирусы внесли изменения в центральную догму молекулярной биологии.
- •Выход из состояния пролиферативного покоя требует специальных регуляторов.
- •У эукариот свой набор днк полимераз
- •Механизм синтеза рнк во многом напоминает синтез днк
- •Транскриптон (оперон) - единица транскрипции.
- •Промоторы имеют сходное строение
- •У эукариот – 3 рнк- полимеразы
- •Транскриптон (оперон) - единица транскрипции.
- •Промоторы имеют сходное строение
- •У эукариот – 3 рнк- полимеразы
- •В транскрипции у прокариот важная роль принадлежит -фактору
- •У эукариот молекула рнк модифицируется после транскрипции.
- •Кэпирование и полиаденилирование иРнКопределяют дальнейшие особенности функций иРнк
- •Сплайсинг – способ создания многообразия белков
- •1.Мультимедийная презентация
Биосинтез тимидиловых дезоксирибонуклеотидов
Синтез дезокситимидиловых нуклеотидов происходит иначе чем других дНТФ, которые образуются непосредственно из рибонуклеотидов под влиянием редуктазы катализирующей преобразование рибонуклеозиддифосфатов в дезоксирибонуклеозиддифосфаты).Термины тимидин и дезокситимидин (или дTTФ и ТТФ) относятся к дезоксирибонуклеотиду, потому что тимидиловый рибонуклеотид не встречается среди нормальных метаболитов. В редких случаях, где имеется тимидиловый рибонуклеотид его обычно обозначают как 'рТТФ'
Синтез тимидиловых нуклеотидов de novo начинается или с УДФ или ЦДФ и приводит к образованию дТТФ . Что касается возможной реутилизации , то образование тимидиловых нуклеотидов начинается с дезоксицитина, дезоксиуридина или дезокситимидина, которые превращаются в соответсвующие нуклеозидмонофосфаты на первом этапе при помощи соответсвующих киназ (см раздел о реутилизации нуклеотидов) Имеются несколько уровней регуляции синтеза. Например, дЦТФ ингибирует реакции реутилизации, катализируемую дезоксицитидин киназой и активизирует реакцию, катализируемую дЦМФ дезаминазой. С другой стороны, дTTФ ингибирует реакцию дезаминирования дЦМФ, а также фермент тимидин киназу.
Механизм образования дезокситимидилового нуклеотида (дТМФ)
Првращение дУМФ в дТМФ сопровождается переносом одноуглеродного фрагмента от 5,10-метилентетрагидрофолата в реакции, катализируемой тимидилат синтазой.
Реакция, катализируемая тимидилатсинтазой - единственная, известная в клетке, в которой ТГФ не регенерирует. Дигидрофолатредуктаза, таким образом, играет существенную роль в окончательной регенерации 5,10 метилен-ТГФ. Этот фермент явялется мишенью при антиопухолевой химиотерапии, так как он ингибируется лекарственным средством метотрексатом.
Обмен дезоксиуридиловых нуклеотидов
Дезоксиуридиловые нуклеотиды являются промежуточными продуктами синтеза тимидиловых нуклеотидов.дУТФ легко узнается ДНК полимеразами и может быть использован для синтеза ДНК вместо дТТФ. При репликации урацила в структуре ДНК образует комплементарную пару с аденином, так что при этом не теряется информация, записанная на ДНК. Однако дУМФ может возникать в структуре ДНК путем спонтанного дезаминирования дЦМФ. В этом случае при репликации возникает мутация, поскольку комплементарное основание цитозина гуанин, а не аденин.
Для предупреждения встраивания уридиновых нуклеотидов в ДНК в клетках действует простой механизм. Фермент дУТФаза, превращает дУТФ (субстрат ДНК полимеразы) в дУМФ (не является субстратом ДНК полимеразы), который используется для синтеза тимидиловых нуклеотидов , поскольку дУМФ превращается вначале дТМФ, а затем и дТТФ.
Наиболее частые проявления нарушений обмена пуринов - гиперурикемия и подагра
Конечный продукт распада пуриновых нуклеотидов мочевая кислота характеризуется низкой растворимостью в воде, ее натриевая соль отличается более высокой растворимостью. Форма, в которой мочевая кислота находится в биологических жидкостях (кровь, моча, спиномозговая жидкость), зависит от рН этой жидкости. Величина рК для протона N9 составляет 5,75, а для протона N-l—10,3. Это означает, что в физиологических условиях, т е. при нормальном рН физиологических жидкостей, можно обнаружить как саму мочевую кислоту, так и ее мононатриевую соль (урат натрия). В жидкостях с рН ниже 5,75 основной молекулярной формой является мочевая кислота. При рН 5,75 кислота и ее соль присутствуют в эквимолярных количествах. При рН выше 5,75 доминирующая форма - натриевая соль мочевой кислоты.
Нарушения пуринового обмена включают гиперурикемию, гипоурикемию и болезни иммунодефицита.
Очень высокая концентрация мочевой кислоты в крови ведет к довольно распространенной группе болезней, называемых подагрой. Частота подагры зависит от страны и составляет около 3/1000. Подагра - группа патологических состояний, связанных с заметно повышенными уровнями урата в крови (в норме 3-7 мг/100 мл). Гиперурикемия не всегда проявляется какими-либо симптомами но, у некоторых людей, способствует осаждению кристаллов урата натрия в суставах и тканях. В дополнение к выраженной боли сопровождающей обострение, повторные приступы приводят к деструкции тканей и тяжелых артритоподобных нарушений. Термин подагра должен быть ограничен гиперурикемией с присутствием таких подагрических отложений.
Ниже приводится таблица, указывающая на возможные причины нарушения обмена пуриновых нуклеотидов
|
Нарушения обмена пуриновых нуклеотидов. |
|||
|
Болезнь |
Дефект |
Природа дефекта |
коментарий |
|
Подагра |
ФРПФ синтетаза |
Увеличение активности фермента из-за повышенный Vmax |
Повышенное образование Гиперурикемия |
|
Подагра |
ФРПФ синтетаза |
Фермент устойчив к торможению продуктами |
Гиперурикемия |
|
Подагра |
ФРПФ синтетаза |
Фермент имеет высокое сродство к рибоза-5-фосфату (снижение Km) |
Гиперурикемия |
|
Подагра |
ФРПФ синтетаза |
Потеря способности к торможению по типу обратной связи |
Гиперурикемия |
|
Подагра |
ГГФРТa |
Частично дефектный фермент |
Гиперурикемия |
|
Синдром Леша-Нихана |
ГГФРТ |
Отсутствие фермента |
См. выше |
|
ТКИД |
АДАb |
Отсутствие фермента |
См. выше |
|
Иммунодефицит |
ПНФc |
Отсутствие фермента |
См. выше |
|
Почечно каменная болезнь |
АФРТd |
Отсутствие фермента |
2,8-дигидроксиадениловый почечный литиаз |
|
Ксантинурия |
Ксантиноксидаза |
Отсутствие фермента |
Гипоурикемия и ксантиновый почечный литиаз |
|
Боллезнь Гирке |
Глюкозо-6-фосфатаза |
Отсутствие фермента |
См. выше |
|
аГипоксантин-гуанин фосфорибозилтрансфераза; bаденозин дезаминаза; cпуриновая нуклеотидфосфорилаза; daденозин фосфорибозил трансфераза ТКИД- тяжелый комбинированный иммунодефицит |
|||
Причинами повышения могут быть нарушения функции трех основных ферментов обмена пуринов рис
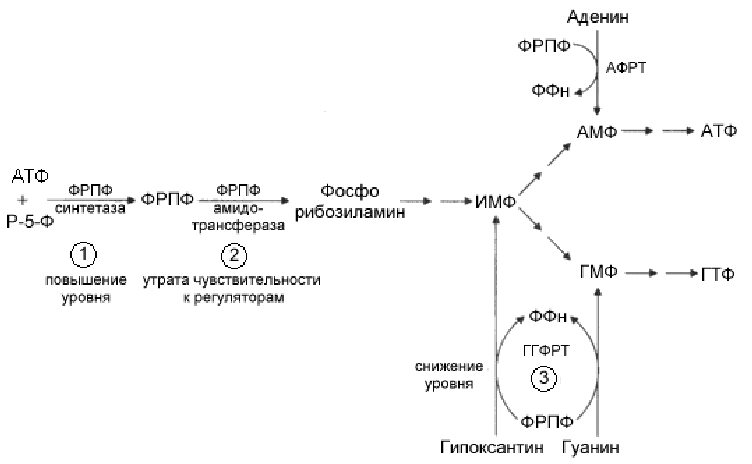 ФРПФ
-синтетазы - Дефекты в структуре этого
фермента могут приводить к потере его
чувствительности к торможению по типу
обратной связи пуриновыми нуклеотидами.
Тем самым, увеличивается образование
пуриновых нуклеотидов и как следствие
- чрезмерный синтез мочевой кислоты..
ФРПФ
-синтетазы - Дефекты в структуре этого
фермента могут приводить к потере его
чувствительности к торможению по типу
обратной связи пуриновыми нуклеотидами.
Тем самым, увеличивается образование
пуриновых нуклеотидов и как следствие
- чрезмерный синтез мочевой кислоты..
Рис.9-25.Основные ферменты метаболизма пуринов, нарушение функции которых ведет к повышению уровня мочевой кислоты.
ФРПФ амидотрансферазы - Дефекты в структуре ФРПФ амидотрансферазы могут приводить к потере чувствительности к торможению по типу обратной связи пуриновыми нуклеотидами, что приводит к повышенному синтезу пуриновых нуклеотидов, мочевой кислоты, и развитию подагры.
Гипоксантин-гуанин фосфорибозилтрансферазы (ГГФРТ). ГГФРТ обеспечивает повторное использование пуринов (для аденинa –аденин фосфорибозилтрансфераза АФРТ). Отношения между дефектом этого фермента и подагрой неясны. Это может быть связано с тем, что субстратом ГГФРТ является ФРПФ. Активность фермента у больных подагрой значительно снижена. Полное отсутствие активности фермента обнаруживается у больных синдромом Леша-Найхана.
Подагра может также быть вызвана нарушениями выделения мочевой кислоты (связанными с неспособностью почечных канальцев выделить мочевую кислоту).
У больных со злокачественными опухолями подагра может возникнуть в результате химиотерапии, при которой происходит гибель клеток, что приводит к повышению образования пуринов за счет нуклеиновых кислот гибнущих клеток
О величине растворимого уратного пула можно судить по содержанию урата натрия в сыворотке крови. Когда этот показатель превышает растворимость урата натрия в сыворотке (гиперурикемия), образуются кристаллы. Содержание урата натрия в сыворотке крови при 37°С составляет 2—6 мг%. Кристаллы могут отлагаться в мягких тканях, особенно в суставах или вокруг них. Эти отложения уратов называются «узлами». Накопление кристаллов урата натрия в тканях, их фагоцитоз полиморфно-ядерными лейкоцитами в суставной щели могут вызывать резкую воспалительную реакцию—острый подагрический артрит. Хронический подагрический артрит приводит к деформации сустава.
В водных растворах мочевая кислота (протонированная форма урата) в семнадцать раз менее растворима, чем ее натриевая соль. Моча при рН 5 становится насыщенной уратами при концентрации 15 мг%. Поскольку рН мочи здоровых людей в норме ниже рК мочевой кислоты (5,75), ураты в моче представлены в основном мочевой кислотой. Если рН мочи достигает 7, то в ней может раствориться 150—200 мг уратов на 100 мл.
Мочевая кислота становится основной формой уратов при рН мочи ниже рН 5,75. Такое значение рН характерно для дистальных канальцев и собирательных трубочек почек. Если кристаллы этого конечного продукта катаболизма пуринов образуются в системе выведения мочи, т.e. в зоне, проксимальной от области закисления мочи, это будут кристаллы урата натрия; в самой же области закисления окажутся кристаллы мочевой кислоты. Поэтому большинство камней, образующихся в мочевыводящих путях, состоят из мочевой кислоты. Интенсивность образования камней мочевой кислоты можно в значительной мере уменьшить, смещая рН мочи в щелочном направлении (при этом будет доминировать более растворимая форма—урат натрия).
Игольчатые кристаллы урата натрия характеризуются отрицательным двойным лучепреломлением (они оптически анизотропны) и потому могут быть идентифицированы с помощью поляризационного микроскопа. Если в синовиальной или суставной жидкости обнаруживаются полиморфноядерные лейкоциты, содержащие кристаллы, окрашенные в желтый цвет при ориентации их длинной оси параллельно направлению поляризованного света и в голубой—при перпендикулярной ориентации, то это кристаллы урата натрия. Однако следует отметить, что в синовиальной жидкости присутствуют также кристаллы пирофосфата кальция, которые характеризуются положительным двойным лучепреломлением; они могут вызывать синдром, получивший название «псевдоподагры».
Синдром Леша—Найхана (полное отсутствие ГГФРТ) наследуется как сцепленный с X-хромосомой рецессивный признак. Болезнь характеризуется корковым параличом, сопровождающимся хореоатетозом, судоргами, стремлением к члено-вредительству и тяжелой гиперурикемией. В моче наблюдается образование камней мочевой кислоты. Матери больных детей гетерозиготны и мозаичны в отношении ГГФРТазной недостаточности, у них часто обнаруживается гиперурикемия, но без неврологических симптомов. Частичная недостаточность ГГФРТазы, вызванная мутациями соответствующего гена, встречается и у мужчин. Для таких больных характерна тажелая гиперурикемия, не сопровождающаяся существенными неврологическимими нарушениями
Избыточное образование пуринов у пациентов с недостаточностью ГГФРТ связано с увеличенной внутриклеточной концентрацией ФРПФ, что, по-видимому, является результатом уменьшения потребления ФРПФ на. пути регенерации пуриновых нуклеотидов. Биохимическая основа некрологических отклонений при синдроме Леша—Найхана неизвестна.
Избыточное образование пуринов и гиперурикемия при болезни Гирке—явление вторичное. Оно обусловлено повышением активности гексозомоно-фосфатного шунта и увеличением образования рибозо-5-фосфата, из которого синтезируетися ФРПФ.
Для больных с недостаточностыо глюкозо--6-фосфатазы характерен хронический молочнокислый ацидоз, приводящий к повышению порога секреции уратов почками, что способствует накоплению уратов в организме.
Все известные дефекты ферментных систем (за исключением глюкозо-6-фосфатазной недостаточности, для которой соответствующих данных не получено приводит к повышению внутриклеточной концентрации ФРПФ). Избыточная продукция пуринов при глюкозо--б-фосфатазной недостаточности, вероятно также обусловлена этим обстоятельством. Вполне возможно, что и другие нарушения обмена пуринов, приводящие к гиперурикемии , в конечном счете связаны с повышением внутриклеточного уровня ФРПФ.
Гипоурикемия обусловлена либо усилением экскреции либо снижением скорости образования уратов. У человека она связана чаще всего с нарушением реабсорбции мочевой кислоты из клубочкового фильтрата, что может приводить к выделению уратов и мочевой кислоты в количествах, которые является неадекватно большим отношению к содержанию уратов в плазме.
Недостаточность ксантиноксидазы, вызванная либо генетнческим дефектом, либо тяжелым поражением печени, приводит к гипоурикемии и увеличение экскреции оксипуринов — гипоксантина и ксантина. При тяжелой недостаточности ксантиноксидазы у пациентов часто развивается ксантннурия и образование ксантиновых камней.
В последние годы
описаны два иммунодефицитных
заболевания, связанные с недостаточностью
ферментов катаболизма пуринов. С
недостаточностью
аденозиндезаминазы
связано тяжелое иммунодефицитное
заболевание, npи
котором снижается количество и
нарушается функция как тимусных
лимфоцитов (Т-клеток), так и лимфоцитов
костного мозга (В-клеток). С недостаточностью
пурнннуклеозид-фосфорилазы
связана более легкая форма иммунодефицита.
при которой функции В-лимфоцитов остаются
нормальными, но сильно нарушены функции
Т-лимфоцитов. Оба заболевания наследуются
по аутосомно-рецессивному типу.
Метаболические нарушения при рассмотренных
иммунных дисфункциях связаны с
накоплением дезоксирибонуклеотидтрифосфатов
(дГТФ и дАТФ). которые аллостерически
ингибируют рибонуклеотидредуктазу,
что, в свою очередь, приводит к
снижению содержания в Т-лимфоцитах пула
предшественников синтеза ДНК, главным
образом dЦТФ.
Пуринодефицитные состояния у человека
встречаются редко. Часто они бывают
связаны с недостатком фолиевой кислоты,
вероятно, витамина В12,
что приводит к снижению синтеза
производных фолата. 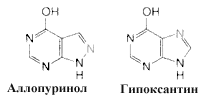
У больных со злокачественными опухолями подагра может возникнуть как осложнение химиотерапии, вызывающей гибель клеток и, как следствие, повышение образования пуринов за счет нуклеиновых кислот гибнущих клеток.
В лечении подагры нашел широкое применение аллопуринол, химическое соединение структурно подобное гипоксантину. Это хороший ингибитор ксантиноксидазы. Его применение приводит к накоплению гипоксантина и ксантина, которые лучше растворимы в воде и легче выделяются, чем мочевая кислота.
