
- •1. Відмінність електрохімічних процесів від хімічних окисно-відновних реакцій
- •2. Основні елементи електрохімічної комірки
- •3. Електроди та реакції, що протікають на електродах
- •4. Кількісні відношення при електролізі
- •4.1 Закон Фарадея
- •4.2 Використання Закону Фарадея
- •Тематичний план до дисципліни "Вступ до спеціальності"
- •Список літератури
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД
«УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ
УНІВЕРСИТЕТ»
МЕТОДИЧНІ ВКАЗІВКИ
ТА КОНТРОЛЬНІ ЗАВДАННЯ ДО ПРАКТИЧНИХ ЗАНЯТЬ З ДИСЦИПЛІНИ "ВСТУП ДО СПЕЦІАЛЬНОСТІ" ДЛЯ СТУДЕНТІВ ІІ КУРСУ НАПРЯМУ 6.0513.01 «ХІМІЧНА ТЕХНОЛОГІЯ», ОРІЄНТОВАНИХ НА СПЕЦІАЛЬНОСТІ 7.0513.0102 ТА 8.0513.0102 "ТЕХНІЧНА ЕЛЕКТРОХІМІЯ"
Затверджено на засіданні кафедри технічної електрохімії.
Протокол № 13 від 29.06.2010.
Дніпропетровськ УДХТУ 2010
Методичні вказівки та контрольні завдання до практичних занять з дисципліни "Вступ до спеціальності" для студентів ІІ курсу денного відділення напряму 6.0513.01 «хімічна технологія», орієнтованих на спеціальності 7.0513.0102 та 8.0513.0102 "Технічна електрохімія" / Укл.: І.Д. Пініелле, В.Л. Коваленко, В.М. Серебритський. – Дніпропетровськ: ДВНЗ УДХТУ, 2010. – 17 с.
Укладачі: І.Д. Пініелле, канд. хім. наук
В.Л. Коваленко, канд. техн. наук
В.М. Серебритський, канд. техн. наук
Відповідальний за випуск М.Д. Кошель, д-р хім. наук
Навчальне видання
Методичні вказівки та контрольні завдання до практичних занять з дисципліни "Вступ до спеціальності" для студентів ІІ курсу напряму 6.0513.01 «Хімічна технологія», орієнтованих на спеціальність 7.0513.0102 та 8.0513.0102 "Технічна електрохімія"
Укладачі: ПІНІЕЛЛЕ Інна Дмитрівна
КОВАЛЕНКО Вадим Леонідович
СЕРЕБРИТСЬКИЙ Василь Михайлович
Редактор Л.М. Тонкошкур
Коректор В.П. Синицька
Підписано до друку 09.09.10. Формат 60841/16. Папір ксерокс. Друк різограф. Ум.-друк. акр. 0,77. Обл.-вид. арк. 0,81. Тираж 40 прим. Зам. № 14. Свідоцтво ДК № 303 від 27.12.2000.
Д ВНЗ
УДХТУ, 49005, м. Дніпропетровськ-5, просп.
Гагаріна, 8.
ВНЗ
УДХТУ, 49005, м. Дніпропетровськ-5, просп.
Гагаріна, 8.
В идавничо-поліграфічний
комплекс ІнКомЦентру
идавничо-поліграфічний
комплекс ІнКомЦентру
В пам'ять про засновника кафедри технічної електрохімії УДХТУ, доктора хімічних наук, професора, члена-кореспондента Казахської АН СРСР, першого вчителя в галузі електрохімії Володимира Вільгельмовича Стендера.
Вступ. ОСНОВНІ ВІХИ В ІСТОРІЇ ВИНИКНЕННЯ ЕЛЕКТРОХІМІЇ
Електрохімія належить до області знань про взаємні перетворення хімічної та електричної форм енергії і про використання цих перетворень.
Відомо, що людина почала освоювати хімічні процеси ще з давніх часів. Це фарбування тканин, дублення шкіри, одержання металів і сплавів, гончарне виробництво. Чи знаходила застосування в древні часи електрика? У древніх текстах не знайдене підтвердження того, що в ті часи вміли одержувати електричний струм і користуватися ним.
З другої половини XVIII сторіччя хімія поступово почала цікавитися електрикою. Наприклад, Роберт Бойль вивчав електризацію тіл, а Бенджамін Франклін потряс увесь світ дослідами з атмосферною електрикою, внаслідок чого відкрив громовідвід. У Росії в області атмосферної електрики у XVIII столітті експериментували академіки Ломоносов і Рихман. М.В. Ломоносов висловив ідею про взаємозв'язок між різними явищами: тепловими, електричними, хімічними і світловими. У 1756 р. Ломоносов поставив задачу з'ясувати, як будова різних речовин та їх хімічні властивості відображаються на електричних властивостях. У плані досліджень передбачався вимір "впливу електричної сили" на розчини. Ломоносов висловив думку, що без хімії шлях до пізнання причини електрики закритий. Тобто, можна стверджувати, що перші уявлення про взаємозв'язок електричної та хімічної видів енергії пов'язані з XVIII століттям та з ім'ям М.В. Ломоносова. Але дослідження зв'язку між цими явищами було неможливе через відсутність джерела постійного електричного струму.
Створення першого хімічного джерела струму звичайно, пов'язують з ім'ям італійських вчених – лікаря-анатома Луіджі Гальвані та фізика Алессандро Вольта. У 1780 р. Гальвані препарував жабу, що лежала на столі. Коли один з асистентів випадково торкнувся кінчиком пінцета внутрішніх стегнових нервів жаби, м'язи суглобів її стали скорочуватися. Скорочення м'язів спостерігалося під дією електричного розряду, що витягається з кондуктора електричної машини. Як виявилося, скорочення м'язів вдавалося викликати і у відсутності розряду, якщо жабу покласти на залізну дошку та доторкнутися дротом, який занурений у спинний мозок жаби, до дошки. При цьому, якщо ланцюг між нервом і м'язом складався з різнорідних металів, скорочення були набагато сильніші, ніж у випадку однорідних металів. Скорочення зовсім не було, коли частина ланцюга складалася з речовин, що не проводять електрики. Напрошувався висновок, що вся справа у взаємодії двох різних провідників – металів, які розділені електропровідним середовищем, у даному випадку препарованою жабою. Але Гальвані назвав цей вид електрики "тваринною електрикою".
У 1792 р. А. Вольта повторив досліди Гальвані. Він написав, що справа не у тваринній електриці, а в тому, що посмикування жаби виникають від проходження через неї "електричного флюїду", тобто струму, що виникає при зіткненні різнорідних металів, а жаба його тільки фіксує скороченням м'язів. Наприкінці 1799 року Вольта винайшов електрохімічний генератор струму, який назвали "вольтів стовп". Цей технічний пристрій складався з двох різнорідних металів, розділених "вологим тілом". Як метали Вольта брав мідь (чи срібло) у вигляді декількох дисків, таку ж кількість цинкових (чи олов'яних) дисків та кружків губчатого матеріалу, просоченого солоною водою. На срібний диск накладали цинковий, потім кружок з губчатого матеріалу, і так далі. Одну комірку такої "споруди" можна навести у такому вигляді:
Zn | NаСl, Н2О | Аg.
Стовп із двадцяти подібних поверхів мав значний заряд. Надалі такі пристрої, в яких не було потрібно витрачати ніякої механічної енергії, щоб одержати електричну, отримали назву гальванічні елементи.
З винаходом «вольтова стовпа» виникло кілька питань: 1) яку дію має проходження електричного струму на хімічні речовини; 2) яким чином електричний струм проходить через розчин; 3) відкіля черпає свою енергію гальванічний елемент; 4) чи можна побудувати гальванічний елемент з інших матеріалів, ніж стовп Вольта; 5) де виникає в джерелі струму електрорушійна сила?
1. Відмінність електрохімічних процесів від хімічних окисно-відновних реакцій
Щоб відповісти на ряд поставлених питань, потрібно чітко уявляти відмінність електрохімічних процесів від хімічних. Електрохімічні реакції протікають за участю заряджених часток. Фактично, кожна хімічна окисно-відновна реакція також протікає за участю заряджених часток, але реакція супроводжується поглинанням або виділенням тепла у вигляді теплового ефекту, а не електричної енергії. Чому? Розглянемо кожне з окисно-відновних перетворень, що здійснюється в звичайній пробірці.
1/2Н2 + 1/2С12 → НС1, (1.1)
Fe3+ + Сu+ → Fe2+ + Сu2+. (1.2)
Реакції (1.1) та (1.2) можливі тільки при зіткненні часток. Отже, перша особливість хімічного процесу – необхідність контакту часток реагентів.
У момент, коли частки зіткнулись, стає можливим перехід електронів. Звідси друга особливість хімічного окисно-відновного процесу – перенос електронів здійснюється на малі відстані (порядку розміру атомів, молекул, іонів), тобто на мікроскопічні відстані.
Крім того, у реакційному об'ємі частки рухаються хаотично, тому перенос електронів може здійснюватися в будь-яких напрямах. Таким чином, третя відмінність хімічних реакцій – ненаправлений рух заряджених часток.
Внаслідок цих особливостей енергія хімічних перетворень виявляється у вигляді теплового ефекту. Очевидно, щоб хімічна енергія реакцій перетворювалася в електричну, необхідно змінити умови протікання реакцій.
Як відомо, одержання або витрата енергії пов'язані з проходженням електричного струму. А струм – це спрямований рух заряджених часток. Тому умови протікання хімічних реакцій треба змінити так, щоб, по-перше, рух заряджених часток здійснювався у визначеному напрямку. По-друге, використання енергії електричного струму можливе тільки у випадку, якщо електрони переносяться на великі відстані (макроскопічні). Отже, для протікання електрохімічних процесів необхідний просторовий поділ компонентів реакцій окиснення та відновлення. Безпосередній же контакт учасників реакції можна замінити контактом з металевими провідниками, тобто провідниками першого роду, по яких електрони будуть переходити від одного учасника реакції (відновника) до іншого (окислювача). Внаслідок того, що компоненти просторово розділені, для забезпечення безупинного проходження електричного струму, реакційний простір заповнюється іонним провідником (провідником другого роду). Звідси ще одна відмінність електрохімічних перетворень – це наявність зміни провідності (електронної на іонну).
Сукупність викладених умов протікання електрохімічних перетворень реалізується в електрохімічних системах, внаслідок чого в них енергія хімічних реакцій перетворюється в електричну енергію або електрична енергія – в хімічну. В останньому випадку реакція (1.1) протікає в зворотному напрямку примусово.
2. Основні елементи електрохімічної комірки
Розглянемо, що собою представляють системи, в яких здійснюються електрохімічні перетворення. Розрізняють два типи систем:
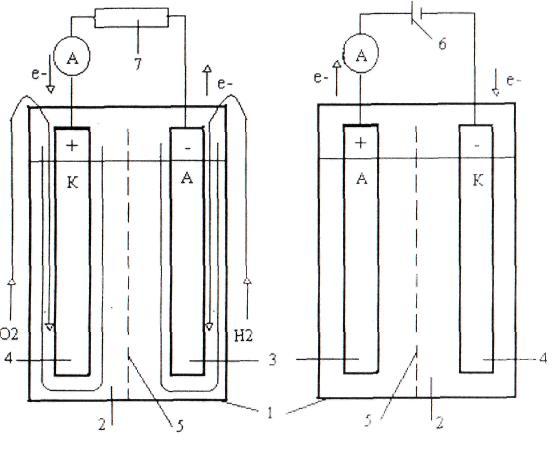
– перша, в якій хімічна енергія реакцій перетворюється в електричну. Називається гака комірка гальванічним елементом або хімічним джерелом струму – ХДС (рис. 1). Реакції в таких системах протікають мимовільно;
– друга, в якій електрична енергія, що підводиться від джерела постійного струму, перетворюється в хімічну. Називається така комірка гальванічною ванною або електролізером (рис. 2). Окисно-відновні реакції в таких системах протікають примусово, в результаті чого в комірці йде розкладання речовин.
Приклади реакцій до рисунків 1 і 2, відповідно:
Мимовільний процес (в ХДС):
Н2 + ½О2 → Н2О ± 2е. (2.1)
Примусовий процес (в електролізері):
Н2О → Н2 + ½О2 ± 2е. (2.2)
Гальванічний елемент Гальванічна ванна
(хімічне джерело струму (ХДС)) (електролізер)
 (+)
О2(Nі)
| NаОН, Н2O
| (Nі)Н2
(–)
(+)
Nі| NаОН, Н2O
| Nі (–)
(+)
О2(Nі)
| NаОН, Н2O
| (Nі)Н2
(–)
(+)
Nі| NаОН, Н2O
| Nі (–)
R навантаження Е джерело струму
Рис 1. Рис. 2.
Структура комірки ХДС Структура комірки електролізера
1 – ємність (корпус); 2 – електроліт; 3 – анод (електрод); 4 – катод (електрод); 5 – перегородка (діафрагма, мембрана); 6 – джерело струму; 7 – навантаження (електричний опір)
Основною частиною систем, які наведені на рис. 1 та 2 є електрохімічна комірка, що складається з ємності (1), яка заповнена розчином солі, кислоти чи розплавом, тобто іонним провідником, який називають електролітом (2). В електроліт занурені електронні провідники (3,4), які називають електродами. Вони можуть бути виконані з металів, графіту або металооксидів. Таким чином, електрохімічні процеси є гетерогенними і реакції протікають на межі електрод–електроліт.
У ряді випадків електродні простори розділяють перегородкою (5): діафрагмою, сепаратором, мембраною, щоб виключити змішування електролітів із електродних просторів або продуктів реакції. За допомогою металевих струмовідводів у зовнішній ланцюг гальванічної ванни підключають джерело струму (6), а гальванічного елемента – навантаження, електричний опір – R (7).
Без яких елементів можлива робота електрохімічної комірки? По-перше, існує достатня кількість комірок без перегородки. Перегородка використовується лише при необхідності. По-друге, можливе існування електрохімічної комірки без корпусу (ємності). Це можливо за умови, коли один з електродів одночасно є корпусом комірки.
