
3.10.2009.
Лекция 8 Свойства растворов электролитов
1. Электропроводность электролитов в растворах
Электрическая проводимость растворов известна с XVIII в, но долгое время этот факт не воспринимался как доказательство постоянного присутствия в растворе заряженных частиц. Заряды, переносящие электричество, могли возникать и перемещаться под действием приложенной разности потенциалов. Когда С. Аррениус выдвинул теорию электролитической диссоциации (1887), большинство современных ему ученых категорически отвергали существование свободных ионов. В качестве основного аргумента, доказывающего реальность ионов в растворах, Аррениус рассматривал не сам факт электрической проводимости (электропроводности), а характер зависимости проводимости от концентрации электролита.
Рассмотрим основные понятия, относящиеся к электрической проводимости. Непосредственно измеряют электрическое сопротивление раствора электролита в ячейке с платиновыми электродами в виде прямоугольных пластинок со стороной 1 – 2 см. Проводником оказывается раствор между электродами.
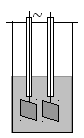
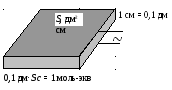
Проводимостью L называется обратная величина электрического сопротивления R. Сопротивление пропорционально удельному сопротивлению проводника ρ и его длине l, и обратно пропорционально площади сечения S. Удельная электрическая проводимость κ численно равна проводимости электролита, заключенного между электродами площадью 1 см2 и находящимися на расстоянии 1 см. Основные формулы:
![]() ;
;
![]() ;
;
![]()
Удельная электрическая проводимость зависит от числа ионов в единице объема и их подвижности. Для более наглядной характеристики свойств электролита и сравнения различных электролитов между собой используется эквивалентная электропроводность 000, определяемая как отношение удельной электропроводности к молярной концентрации эквивалента:
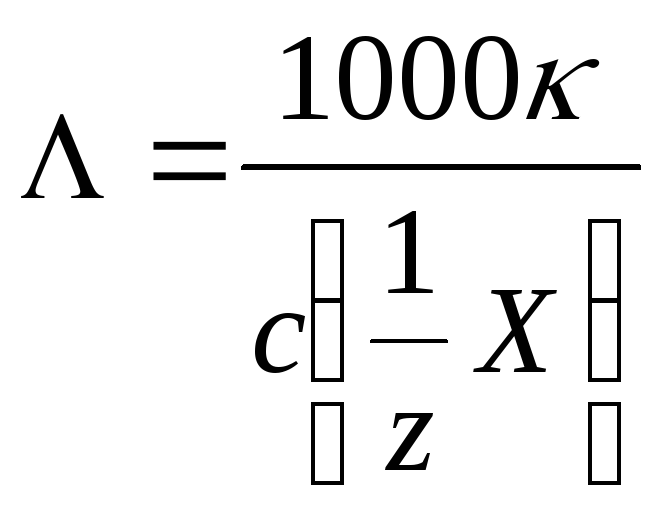
Множитель 1000 см3·л–1 введен в формулу в связи с тем, что концентрация выражается в моль/л. Единица измерения эквивалентной электропроводности Ом–1·см2·моль–1. Физический смысл Λ можно уяснить следующим образом: это проводимость объема раствора, в котором заключено количество электролита, способное образовать ионы с суммарным зарядом F как для положительных, так и для отрицательных ионов; при этом весь раствор находится между пластинами электродов, имеющих необходимую площадь и с расстоянием между ними 1 см. При уменьшении концентрации мы должны представить себе увеличичение площадь электродов, так что между ними по прежнему находится 1 моль-экв электролита.
Эквивалентная электропроводность тоже зависит от концентрации электролита по двум главным причинам: 1) Притяжение между ионами тормозит их движение в электрическом поле, вызывая кажущееся уменьшение концентрации. При сильном («бесконечном») разбавлении раствора действие этого эффекта ослабевает, и эквивалентная электропроводность постепенно приближается к максимальному значению Λ∞. 2) Некоторая доля электролита может находиться в растворе в молекулярном состоянии, в результате чего реальное количество ионов резко уменьшается, и электропроводность оказывается ниже, чем при распаде всех молекул. При разбавлении раствора равновесие смещается в направлении образования ионов, и эквивалентная электропроводность также приближается к максимальному значению Λ∞. В эквивалентную электропроводность дают свой вклад как катионы, так и анионы в соответствии с их подвижностью. Максимальная электрическая проводимость электролита вычисляется по закону Кольрауша как сумма предельных молярных электрических проводимостей катионов и анионов, λ+ и λ–:
Λ∞ = λ+ + λ–
Предельные молярные электрические
проводимости некоторых ионов (25ºС)
|
|
λ+, Ом–1·см2·моль–1 |
|
λ–, Ом–1·см2·моль–1 |
|
H+ |
349,65 |
OH– |
119 |
|
Li+ |
38,7 |
F– |
55,4 |
|
Na+ |
50,1 |
Cl– |
73,3 |
|
K+ |
73,5 |
Br– |
78,1 |
|
NH4+ |
73,5 |
1/2SO24– |
80,0 |
|
1/2Mg2+ |
53,0 |
NO3– |
71,4 |
|
1/2Ca2+ |
59,5 |
1/2CO32– |
69,3 |
|
1/3Al3+ |
61 |
CH3COO– |
40,9 |
|
1/2Fe2+ |
54 |
HCO3– |
75 |
Среди данных таблицы обращают на себя внимание высокие значения 000 ионов H+ и OH–. Особая подвижность этих ионов объясняется эстафетным механизмом проводимости, когда движется в электрическом поле не ион как таковой (H3O+ и OH–), а протон, необычайно быстро перемещающийся от одной частицы к другой.
