
67,15 Г металла эквивалентны 32,85 г серы
Мэк(Ме) эквивалентна Мэк(S)=16 г/моль серы.
Откуда
![]() г/моль.
г/моль.
Пример 1.6. На восстановление 1г оксида металла израсходован 421 см3 водорода (нормальные условия (н.у.)). Вычислить молярные массы эквивалентов оксида и металла.
Решение. Число эквивалентности молекулярного водорода Н2 равно двум, следовательно, молярная масса эквивалентов водорода
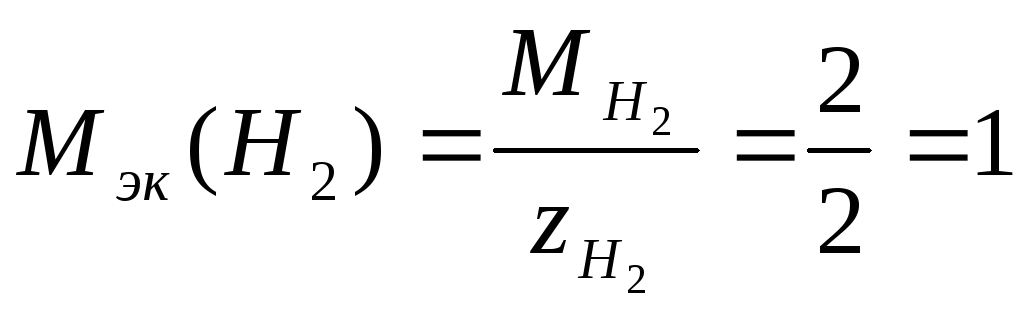 г/моль.
г/моль.
В соответствии с законом Авогадро объем 1 моль водорода при н.у. составляет 22,4 л, следовательно, молярный объем эквивалентов водорода при н.у.
 л/моль = 11200 см3/моль.
л/моль = 11200 см3/моль.
![]() В
соответствии с законом эквивалентов
масса оксида и объем водорода, вступившие
в реакцию, пропорциональны молярным
массам (молярным объемам) их эквивалентов.
Значит,
В
соответствии с законом эквивалентов
масса оксида и объем водорода, вступившие
в реакцию, пропорциональны молярным
массам (молярным объемам) их эквивалентов.
Значит,
1г оксида эквивалентен 421 см3 водорода
Мэк(оксид) эквивалентна 11200 см3/моль водорода.
Откуда
![]() г/моль.
г/моль.
Любой оксид состоит из кислорода и другого элемента, соединенных в эквивалентных количествах. Следовательно, молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и металла, образующего оксид:
Мэк(оксид)=Мэк( металл) + Мэк(О)
Число эквивалентности кислорода zO=2, значит,
![]() г/моль
г/моль
Таким образом, молярная масса эквивалентов металла, образующего оксид, составляет
Мэк( металл)= Мэк(оксид) - Мэк(О)= 26,6 – 8 =18,6 г/моль.
Закон Авогадро. Открыт в 1811г. итальянским физиком А.Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
При
нормальных условиях (температура 0
оС=273,15 К и давление 1 атм =760 мм
рт.ст.= 101325 Па=101,325кПа) один моль любого
газа содержит 6,022045.1023
![]() 6,02.1023
молекул (постоянная Авогадро) и занимает
объем 22 414 см3
6,02.1023
молекул (постоянная Авогадро) и занимает
объем 22 414 см3![]() 22,4
дм3 .
22,4
дм3 .
Закон Авогадро позволяет определить молярную массу газа, если известна его плотность (ρ) при нормальных условиях:
МВ=22,4 ρ, (1.7)
или плотность при нормальных условиях, если известна молярная масса. Можно также определить молярную массу неизвестного газа (Мх), зная молярную массу известного газа (МВ) и отношение плотностей этих газов (ρх/ρВ):
![]() (1.8)
(1.8)
Отношение ρх/ρВ носит название относительной плотности одного газа по другому и обозначается буквой D. Например, если использовать относительную плотность неизвестного газа по водороду и воздуху, то формула (1.8) запишется следующим образом:
![]() (1.8а)
(1.8а)
![]()
![]() (1.8б)
(1.8б)
Если условия, при которых находится газ, не сильно отличаются от нормальных, то для определения молярной массы газа используют уравнение состояния идеальных газов Менделеева _ Клапейрона.
Пример 1.7. Какой объем занимает 1г углекислого газа при н.у.?
Решение. Молярная масса углекислого газа СО2 составляет 44 г/моль. Из закона Авогадро следует, что при нормальных условиях
44г углекислого газа занимают объем 22,4л
1г углекислого газа занимают объем Vo л.
Следовательно,
![]() л.
л.
Пример 1.8. Относительная плотность газа по водороду составляет 6. Какой объем будут занимать 2г этого газа при н.у.?
Решение. Определяем молярную массу газа по уравнению (1.8а):
М = 2,016.6= 12,096 г/моль.
В соответствии с законом Авогадро
12,096г газа занимают объем 22,4л
2г газа занимают объем Vо л.
Откуда
![]() л.
л.
Закон кратных отношений. Открыт английским ученым Д.Дальтоном в 1804г. Если два элемента образуют между собой несколько химических соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа. Например, массы азота и кислорода в соединениях N2O и NO относятся как 0,875:1 и 0,4375:1. Следовательно, массы азота, соединяющиеся с одной и той же массой кислорода, относятся между собой как 2:1.
Рассмотренные в этом параграфе и некоторые другие законы легли в основу атомно-молекулярной теории _ основы современной химии.
