
- •Вводный курс
- •1. Основные понятия
- •1.1. Атом, молекула. Элемент, простое вещество,
- •1.2. Моль. Молярная масса. Закон Авогадро.
- •1 Моль газа занимает объем 22,4л
- •1 Моль серной кислоты содержит 6,02.1023 формульных единиц h2so4
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •Контрольные вопросы и задачи
- •2. Периодическая система элементов д.И.Менделеева
- •2.1. Строение атома
- •2.2. Периодическая система
- •Контрольные вопросы и задачи
- •3. Основные классы неорганических веществ
- •3.1. Металлы. Неметаллы.
- •3.2. Бинарные соединения (оксиды, галогениды, сульфиды)
- •3.3. Гидроксиды (кислоты, основания, амфотерные гидроксиды)
- •3.4. Соли
- •3.5.Электролитическая диссоциация гидроксидов и солей
- •Контрольные вопросы и задачи
- •4. Окислительно-восстановительные процессы
- •4.1. Основные понятия
- •4.2. Уравнивание окислительно-восстановительных реакций
- •Контрольные вопросы и задачи
- •5. Способы выражения концентраций растворов
- •5.1. Массовая доля
- •100Г раствора содержат 5г CuSo4
- •160Г CuSo4 содержатся в 250г CuSo4.5н2о
- •100Г 98 % раствора содержат 98г н2so4
- •Основной курс
- •1. Введение
4. Окислительно-восстановительные процессы
4.1. Основные понятия
Степень окисления элементов в ходе химических реакций может не изменяться, и такие реакции называют обменными. Примерами обменных реакций могут быть реакции взаимодействия кислот и оснований (реакции нейтрализации).
В то же время очень многие реакции сопровождаются изменением степеней окисления участвующих в них элементов, например:
2Mg + O2 = 2MgO.
Степень окисления магния и кислорода до реакции равна нулю. В ходе реакции магний, как типичный металл отдаёт 2 электрона и приобретает заряд 2+ , а кислород, как типичный неметалл принимает 2 электрона и приобретает заряд 2-. Эти процессы можно записать в виде схем:
Mg - 2e → Mg2+,
O + 2e → O2-.
Процесс потери электронов называют окислением, а вещество, отдающее электроны является восстановителем; магний является восстановителем, он окисляется. Процесс принятия электронов называют восстановлением, а вещество, принимающее электроны является окислителем; атом кислорода является окислителем, он восстанавливается.
Реакции, сопровождающиеся передачей электронов от одного вещества к другому и изменением степеней окисления участников реакции, носят название окислительно-восстановительных реакций.
Процессы окисления и восстановления протекают всегда одновременно; окисление одного вещества всегда связано с восстановлением другого.
Для составления уравнений окислительно-восстановительных реакций необходимо уметь определять степени окисления элементов в соединениях. Под степенью окисления или окислительным числом понимают условный заряд, который приобрел бы атом, если бы все
общие электроны, образующие химическую связь, целиком принадлежали одному из атомов, обычно атому неметалла.
Степень окисления элементов (С.О.) определяют на основе следующих правил:
1) в простых веществах С.О.=0;
2) для металлов первой группы главной подгруппы (Li, Na, K) С.О.=+1,
3) для металлов второй группы главной подгруппы (Be, Mg, Ca) С.О.=+2;
4) для кислорода С.О.= -2;
5) для водорода С.О.= +1;
6) для галогенов в бинарных соединениях с металлами С.О.= -1;
7) в соединениях отрицательная степень окисления относится, обычно, к неметаллам, а положительная – к металлам;
8) алгебраическая сумма положительных и отрицательных степеней окисления в нейтральной молекуле равна нулю, а в ионе – заряду иона.
Пример 4.1. Определите степень окисления фосфора в фосфате натрия Na3PO4.
Решение. Обозначим степень окисления фосфора через Х. Степень окисления иона натрия (+1), следовательно, сумма степеней окисления трех ионов натрия составляет 3.(+1)=+3. Степень окисления кислорода составляет (-2), следовательно, сумма степеней окисления четырех атомов кислорода составляет 4.(-2)=-8. Сумма степеней окисления всех атомов равна нулю: (+3)+(-8)+Х=0. Таким образом, степень окисления серы Х=5.
Окислители и восстановители. В соответствии с окислительно-восстановительными свойствами все вещества делят на три группы:
1) Окислители. Окислителями являются вещества, способные только принимать электроны и неспособные к их отдаче. К окислителям относятся:
а) катионы металлов в высших степенях окисления, например Sn4+, Pb4+;
б)
анионы, содержащие элементы в
высших степенях окисления, например:
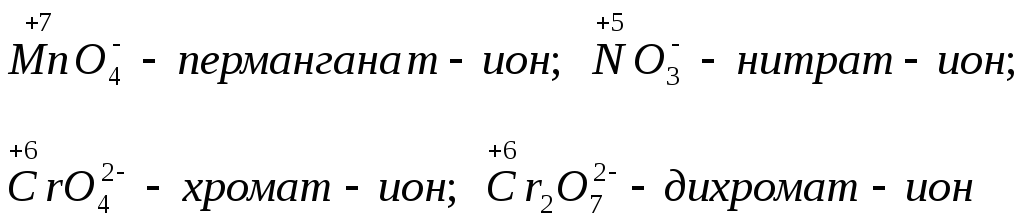
в) из простых веществ к этой группе принадлежит только фтор F2;
2) Восстановители. Восстановителями являются вещества, способные только отдавать электроны и неспособные их принимать. К восстановителям относятся:
а) металлы 1-й и 2-й групп главных подгрупп;
б) соединения, содержащие элементы в наименьшей степени окисления, например H2S; PH3; СН4; SiH4 ;
3)
Окислители-восстановители. К ним
относятся вещества, способные, в
зависимости от условий принимать или
отдавать элетрны. К этой группе почти
все неметаллы (N2;
Cl2; C;
O2; Si
и др.), катионы металлов в промежуточных
степенях окисления (Fe2+;
Pb2+; Cr3+
и др)., анионы, содержащие элементы в
промежуточных степенях окисления:
![]() и
др. и многие другие соединения, содержащие
элементы в промежуточных степенях
окисления: СО; SO2;
NO2 и т.д.
и
др. и многие другие соединения, содержащие
элементы в промежуточных степенях
окисления: СО; SO2;
NO2 и т.д.
