
- •2.Значение биохимии для диагностики заболеваний.
- •3. Значение биохимии для лечения. Выявление нарушенных звеньев метаболизма и создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
- •4.Значение биохимии для профилактики заболеваний.
- •1 .Альфа спираль ( л.Поллинг) - виток составляет от 3 до 6 ак. Терминатором спирали является ак-пролин.
- •2.Бетта складчатый слой.
- •3.Петли полипептидной цепи (соединительные петли).
- •2.Способность белков связываться с лигандами,
- •3.Электрохимические свойства белков.
- •1. Концевыми соон и nh2 группами.
- •2.Боковыми группами:
- •1.Ионообменная хроматография.
- •2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: альбумины, альфа, альфа-2, гамма, бета - глобулины.
- •3.Коллоидные свойства белков.
- •4. Гидратация белков - способность белков связывать воду. Она осуществляется за счёт:
- •1 .Белковой частью (состоит из ак) - апофермент;
- •2.Небелковой частью - кофактор.
- •4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Различают следующие виды специфичности:
- •1.Обратимые - это соединения, которые нековалентно взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
- •1 .Механизм окислительного фосфорилирования.
- •2.Альтернативные пути биологического окисления.
- •3.Свободно-радикальное окисление.
- •1.Мембрана митохондрий не проницаема для протонов.
- •2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
- •3.Обратный транспорт протонов в матрикс сопряжен с образованием атф.
- •2. Вторичные радикалы (он, липидные радикалы – l,, lo,, loo,) Их образование происходит с участием железа (11). Это патологические продукты.
- •3. Третичные радикалы (антиоксиданты) - образуются под влиянием вторичных радикалов.
- •2.Она раздражает слизистую оболочку жкт, усиливая секрецию желёз.
- •3.Усиливает сокращение кишечника,
- •4.В толстом кишечнике под действием ферментов условно-патогенной микрофлоры клетчатка подвергается брожению с образованием глюкозы, лактозы и газообразных веществ.
- •1. Основной фосфоролитический путь
- •2.Неосновной амилолитический.
- •1.Надф*н2, который в отличии от надн2 не используется вдыхательной цепи митохондрий, а поступает клетке для реакций синтеза и восстановления веществ.
- •2.Рибозо-5-фосфата и др. Пентоз, которые используются в клетке для синтеза важнейших биологических молекул: днк, рнк, нтф (атф, гтф, цтф, ттф),н5коа, над, фад).
- •1. Транскетолазные реакции:
- •2. Трансальдолазная реакция:
- •1. Ув пищи,
- •2. Гликоген тканей
- •3. Глюконеогенез.
- •1.Липиды, их классификация и биологическая роль.
- •2.Превращение липидов в органах пищеварения.
- •1.Структурными липидами.
- •2.Резервными липидами.
- •3.Свободными липидами. — хиломикроны,
- •1. Эмульгируют пищевые жиры.
- •2. Активируют липолитические ферменты.
- •3. Выполняют роль переносчиков трудно растворимых в воде продуктов гидролиза жира и жирорастворимых витаминов a, d, е, к.
- •1.Транспортные липопротеины крови. Состав и биологическая роль. 2.Простагландины, простациклины, тромбоксаны, лейкотриены. Механизм их образования и биологическая роль.
- •3.Окисление глицерина и вжк в тканях.
- •1.Простагландины:
- •1.Биосинтез вжк в тканях, химизм реакций, биологическая роль. 2.Холестерин, биологическая роль, биосинтез, окисление. 3.Патология липидного обмена.
- •1.Наличие атф, со2, н2о, надф*н2, поступающий из гексозомонофосфатного пути превращения глюкозы.
- •2.Наличие специальных белков-переносчиков (hs -апб). 3.Наличие специальных ферментов синтеза.
- •1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
- •2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина d3
- •1. Пища. За сутки в организм взрослого человека поступает 0,3гр. Холестерина.
- •1 .На этапе поступления жиров с пищей:
- •2.На этапе пищеварения.
- •2.На этапе пищеварения.
- •2.Бета -аминоизобутират.
- •1. Нарушение на этапе поступления белков. В норме в организм должно поступать 80 – 100гр белков. Обязательно поступление всех незаменимых ак.
- •2. Нарушение на этапе пищеварения:
- •3. Нарушение межуточного обмена - нарушение обмена аминокислот в тканях.
- •5. Праймеры - «затравка» для репликации. Это короткий фрагмент, состоящий из рибонуклеотидтрифосфатов (2 - 10). Образование праимеров катализируется праймазой.
- •1.Инициация репликации.
- •2. Репарация днк.
- •3. Транскрипция гена.
- •1.Рекогниция (распознавание) - узнавание между аминокислотами и их транспортной
- •3. Инициация - начало процесса трансляции.
- •4. Элонгация (продолжение) протекает циклически в виде последовательной смены трёх фаз:
- •5. Терминация (прекращение).
- •6. Броцессинг белка (созревание) совокупность химических модификаций
- •1. Регуляция происходит только на уровне транскрипции. Первичные транскрипты генов у них транслируются до завершения транскрипции.
- •1. Первые представления о гене.
- •2. Современные представления о природе биохимического полиморфизма.
- •3. Современные представления структурно-функциональной организации днк.
- •1. Выделение днк из биологического материала.
- •2. Амплификация - репликация на органическом участке молекулы днк. Производится за счёт работы ферментов и смены температурных режимов.
- •3. Детекция продуктов pcr (копий заданного участка) Схема pcr:
- •1. Структурные гены
- •2. Регуляторные элементы
- •1. Фенотипическое различие между клетками,
- •2. Индивидуальные различия между организмами одного вида. Каждый человек отличается от другого человека на 0,1% генома.
- •3. Широкое разнообразие белков. На основе 35000 генов синтезируются около 5000000 белков. В настоящее время нельзя сказать точно, что изучать важнее - геном или белковый состав организма.
- •1. Углеводный обмен:
- •Высококалорийное питание,
- •Преобладание консервированных продуктов в рационе, рафинированных или высокоочищенных продуктов,
- •Малое движение (гиподинамия).
- •Регулирует интенсивность свободно радикальных процессов. Препятствует активации перекисного окисления жиров, обеспечивая тем самым стабильность биологических мембран.
- •Витамин е повышает биологическую активность витамина а.
- •1. Участие в окислительно-восстановительных реакциях:
- •2. Синтез кортикостероидов
- •Высокая потребность,
- •Неустойчивость химической структуры,
- •Отсутствие депо.
- •1. Входит в состав тдф: тиамин(атф) ® тдф
- •2.Участвует в передаче нервного импульса.
- •I. Метилирование в12
- •2.Деметелирование в12 метилтетрогидрофолевая к-та ® тетрогидрофолевая к-та
- •II. Аденозилкобаламин в12
- •1. Является ко-ферментом карбоксилаз пвк, ацетил -коа, пропионил-коа.
- •2. Участвует в реакциях синтеза жирных кислот и стерина.
- •1. Входит в состав ко-фермента а, следовательно, участвует в синтезе ацетил-коа, различных ацил-коа, образующихся в результате следующих реакций:
- •2. Участвует в синтезе более 80 различных ферментов.
- •Витаминоподобные вещества.
- •1. Прямо воздействующие:
- •2. Структуры аналогичные витаминам:
- •1. Надпеченочная желтуха (гемолитическая).
- •2. Печеночная желтуха (токсические и вирусные и другие гепатиты).
- •3. Подпеченочная желтуха (механическая).
- •1. Транспортирует ионы меди, связывает и удерживает их в кровеносном русле
- •3. Обладает противовоспалительным действием
- •4. Является антиоксидантом, обезвреживает активные формы кислорода и пол.
- •IgD. Функция неизвестна.
- •1. Метаболиты: аминокислоты (25%), креатин (5%), полипептиды и нуклеотиды (3,5%)
- •2. Конечные азотистые продукты: мочевина(50%), мочевая кислота (4%), креатинин (2,5%), индикан и аммиак.
- •1.Экскреторная функция - это выделение мочевины, мочевой кислоты, креатина, лекарств, токсинов, избытка воды, микроэлементов, электролитов. Состоит из трёх фаз:
- •2.Регуляторная и гомеостатическая.
2.На этапе пищеварения.
A. При поражении печени и кишечника нарушается образование и транспорт ЛП крови.
B. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт в этих условиях к застою и образованию холестериновых камней, центрами образования которых служат слущивающиеся клетки эпителия. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
C. Если поражается слизистая оболочка кишечника и нарушается выработка и поступление ферментов ПЖЖ, содержание жира в кале увеличивается. Если содержание жира будет превышать 50%, развивается СТЕАТОРЕЯ. Кал становится бесцветным.
D. Наиболее часто в последнее время среди населения встречается поражение бета -клеток ПЖЖ, что ведйт к развитию сахарного диабета, который сопровождается интенсивным окислением в клетках белков и жиров. В крови у таких больных отмечается ГИПЕРКЕТОНЕМИЯ, ГИПЕРХОЛЕСТЕРИНЕМИЯ. Кетоновые тела и холестерин синтезируются из АЦЕТИЛ-КОА.
3.На этапе обмена холестерина наиболее частым заболеванием является АТЕРОСКЛЕРОЗ, когда в клетках органов и тканей откладывается холестерин. Если холестерин откладывается в стенках сосудов, то происходит нарушение образования крови, следовательно, развиваются тромбозы, инфаркты.
Болезнь развивается тогда, когда между клетками тканей и ЛП крови растёт содержание АТЕРОГЕННЫХ ФРАКЦИЙ и понижается содержание ЛПВП, назначение которых удалять холестерин из клеток тканей в печень для последующего его окисления. Все ЛП за исключением ХИЛОМИКРОНОВ, которые содержат много белков и ФОСФОЛИПИДОВ быстро метаболизируются. ЛПНП задерживаются в сосудистой стенке. Они содержат много ТРИГЛИЦЕРИДОВ и ХОЛЕСТЕРИНА. Они, фагоцитируясь, разрушаются ферментами ЛИЗОСОМ, за исключением холестерина. Он накапливается в клетке в большом количестве. Клетки разрушаются и гибнут. Холестерин откладывается в межклеточном пространстве и инкапсулируется соединительной тканью. В сосудах образуются АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ. Способствуют развитию заболевания: повреждение сосудов токсинами при курении, алкоголизации, сахарном диабете (кетоновые тела), употребление обильной жирной пищи.
Лекция № 16. Обмен белков.
1. БЕЛКОВОЕ ПИТАНИЕ.
2. ПРЕВРАЩЕНИЕ БЕЛКОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
3. ГНИЕНИЕ БЕЛКОВ. ОБРАЗОВАНИЕ ТОКСИЧЕСКИХ ПРОДУКТОВ И МЕХАНИЗМ ИХ ОБЕЗВРЕЖИВАНИЯ.
В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр. белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде.
Все АК можно разделить на 4 группы:
1 .Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР.
2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ.
3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ.
4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется:
1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АК может быть лимитирующей в процессе синтеза белка.
2. Аминокислотным составом белка. Все АК могут содержаться в продуктах как животного, так и растительного происхождения. Суточная потребность человека в белках составляет 100гр.
Пищевые белки подвергаются гидролитическому расщеплению под действием целой группы ферментов ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, т.е. в форме ПРОФЕРМЕНТОВ, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛЗА. Это предохраняет стенки органов ЖКТ от само переваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержаться ГЕТЕРОПОЛИСАХАРИДЫ. Они не подвергаются действию ферментов. Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН=5-6). В ротовой полости белки не подвергаются каким-либо химическим превращениям, т.к. здесь отсутствуют ферменты, действующие на белки. Здесь происходит лишь механическая переработка пищи. В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: ПЕПСИН и ГАСТРИКСИН.
ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме -ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ. ПЕПСИНОГЕН активируется очень медленно, а пепсин потом становится активатором молекул ПЕПСИНОГЕНА. От ПЕПТИДНОЙ цепи неактивного ПЕПСИНОГЕНА со стороны N-конца отрывается один ПЕПТИД, содержащий 42 аминокислоты - активация путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Затем из остатка цепи формируется новая трёхмерная структура фермента - пепсина и новый активный центр. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков:
активирует ПЕПСИНОГЕН, превращая его в пепсин, создаёт оптимум рН для действия пепсина (1,5 - 2), обладает бактерицидным действием, денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина, способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами. ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи, в образовании которых участвуют ДИКАРБОНОВЫЕ аминокислоты (ГЛУ, АСП) своими КАРБОКСИЛЬНЫМИ группами. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник.
В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ, которые вырабатываются в неактивной форме: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА.
Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму.

ТРИПСИН, ХИМОТРИПСИН, ЭЛАСТАЗА - ЭНДОПЕПТИДАЗЫ.
ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ. ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФЕН). ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС. В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты. КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца. АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты. ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе).

1.РЕАКЦИЯ ДЕКАРБОКСИЛИРОВАНАЯ.
А ОРНИТИН в состав белков не входит, но обязательно содержится в организме
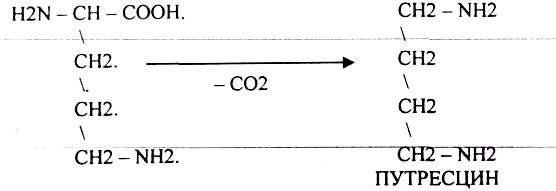
В. ЛИЗИН

ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами. Они входят в состав трупных
ядов.
2.ВОССТАНОВИТЕЛБНОЕ ДЕЗАМИНИРОВАНИЕ.
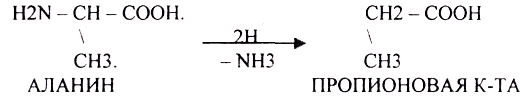
З.ДЕСУЛЬФИРОВАНИЕ - восстановительный процесс.

4.распад боковой цепи циклических аминокислот.
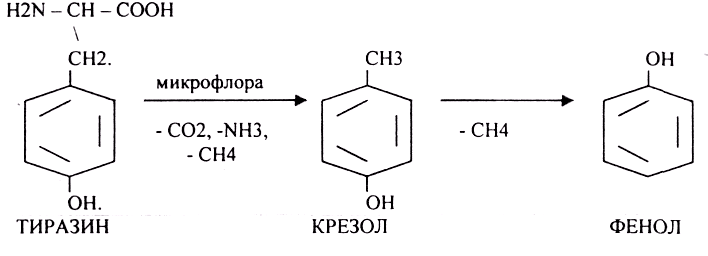

Все эти вещества токсические, образующиеся при гниении поступают в печень, где и происходит их обезвреживание. В печени имеется две системы, участвующие в обезвреживании этих веществ:
1. УДФГК - УРИДИНДИФОСФОГЛЮКУРОНОВАЯ К-ТА.
2. ФАФС - ФОСФОАДЕНОЗИНФОСФОСУЛЬФАТ.
Процесс обезвреживания - это процесс конъюгации токсических веществ с одной из этих систем и образование конъюгатов, которые являются уже нетоксическими веществами.

50.
Индол предварительно подвергается ГИДРОКСИЛИРОВАНИЮ.

ИНДОКСИЛСУЛЬФАТ нейтрализуется и превращается в натриевую или калиевую соль.
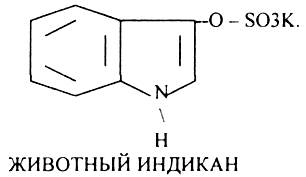
Все эти вещества выводятся из организма с мочой. В норме реакция на индол должна быть отрицательна. При положительной реакции на индол - нарушена детоксикационная функция печени. Положительная реакция на ИНДИКАН наблюдается при очень активном гниении белков в толстом кишечнике.
Лекция № 17.
Обмен белков (продолжение).
1. ИСТОЧНИКИ АМИНОКИСЛОТ В КЛЕТКЕ И ПУТИ ИХ ИСПОЛЬЗОВАНИЯ.
2. МЕТАБОЛИЗМ АМИНОКИСЛОТ.
3. ОБРАЗОВАНИЕ АММИАКА И ПУТИ ЕГО ОБЕЗВРЕЖИВАНИЯ. СИНТЕЗ МОЧЕВИНЫ.
Источниками аминокислот в клетке являются:
1. белки пищи после их гидролиза в органах пищеварения,
2. синтез заменимых аминокислот,
3. распад тканевых белков.
Тканевые белки подвергаются гидролитическому расщеплению при участии тканевых ПРОТЕАЗ - КАТЕПСИНОВ, которые в основном находятся в ЛИЗОСОМАХ, но могут быть и в МИТОХОНДРИЯХ и ЭПС.
Эти ферменты обладают специфичностью действия. Выделяют разные КАТЕПСИНЫ. которые отличаются оптимумом рН и специфичностью действия на ПЕПТИДНЫЕ связи. Распад тканевых белков необходим для обновления белков, а также для устранения дефектных молекул белка.

Часть аминокислот в тканях подвергается различным метаболическим превращениям.
1. Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ -реакции между АМИНО- и КЕТОКИСЛОТАМИ, когда они обмениваются своими функциональными группами, при этом аминокислоты являются донорами аминогрупп, а кетокислоты - их акцепторами. Эти реакции катализирует фермент -
51.
АМИНОТРАНСФЕРАЗА. Она локализуется в МИТОХОНДРИЯХ и ЦИТОПЛАЗМЕ. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. В организме человека обнаружено 10 различных АМИНОТРАНСФЕРАЗ. Наибольшее значение имеют AT, донорами аминогрупп которых являются АЛА, АСП, ГЛУ. ГЛУТАМИНОВАЯ кислота является универсальным донором, а альфа -КГК - универсальным акцептором аминогрупп.

Роль реакций ТРАНСАМИНИРОВАНИЯ:
1. используются для синтеза заменимых аминокислот. При этом происходит перераспределение азота в органах и тканях.
2. Является начальным этапом катаболизма аминокислот
3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа -КЕТОКИСЛОТЫ, которые поступают в ЦТК и включаются в ГЛЮКОНЕОГЕНЕЗ.
4. Протекают в разных тканях, но более всего в печени. Определение активности AT имеет диагностическое значение в клинике. АСАТ наиболее активна в миокарде, следовательно, повышение в сыворотке крови АСАТ можно предположить патологию в сердечной мышце. АЛАТ (АЛАНИНОВАЯ AT) особенно активна в печени, следовательно, повышение её в сыворотке крови свидетельствует о деструктивных изменениях в печени. При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ:
1. АЛА + альфа-КГК ↔ ГЛУ + ПВК
2. ГЛУ + ЩУК ↔АСП + альфа-КГК
2.Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2. При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ). Среди них могут быть соединения, которые выполняют функции:
1. НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИН, ДОФАМИН, ГАМК),
2. Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН),
3. Регуляторы местного действия ( ГИСТАМИН).

ГАМК является НЕИРОМЕДИАТОРОМ тормозного действия, поэтому препараты на основе ГАМК используются в клинике для лечения некоторых заболеваний ЦНС. Эта реакция используется в педиатрической практике: детям при сильном возбуждении используют раствор витамина В6, который стимулирует процесс образования ГАМК. ДОФАМИН является НЕИРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОР АДРЕНАЛИНА.
52.

ГИСТАМИН повышает секрецию желудочного сока, поэтому применяется в клинической практике при зондировании. Обладает сосудорасширяющим действием, понижает АД.

3.Реакции ДЕЗАМИНИРОВАНИЯ - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды ДЕЗАМИНИРОВАНИЯ.
1. Восстановительное

2.ГИДРОЛИТиЧЕСКОЕ:

3. Внутримолекулярное:

Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении, т.е. идут в толстой кишке.
4. Окислительное. Протекает в клетке. Непосредственно, ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ. 53.

ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ. Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ). Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кровь системы воротной вены, здесь концентрация аммиака больше, чем в общем кровотоке.
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 - 0,7мг/л). Особенно выраженное токсическое действие он оказывает на нервные клетки, поэтому значительное его повышение приводит к серьёзным нарушениям обменных процессов в нервной ткани.
ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА.
1. образование АМИДОВ

ГЛУТАМИН и АСПАРАГИН - нетоксические вещества. Их называют транспортной формой аммиака в организме. Они не проникают через мембраны и в почках распадаются до аминокислот и аммиака.
2. Восстановительное АМИНИРОВАНИЕ.

3. Образование солей АММОНИЯ.
![]()
4. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ.
КАРБОМОИЛФОСФАТ
![]()
54.


АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе
мочевины содержится два атома азота: один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в
МИТОХОНДРИЯХ, остальные в цитоплазме.
В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино-
образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из
организма, как конечный продукт азотистого обмена.
Лекция № 18.
Распад НУКЛЕОПРОТЕИНОВ. Нарушение обмена белков.
1.ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОПРОТЕИНОВ.
2.ОБРАЗОВАНИЕ МОЧЕВОЙ КИСЛОТЫ. 3.ОБРАЗОВАНИЕ КРЕАТИНИНА. 4.НАРУШЕНИЕ ОБМЕНА БЕЛКОВ.
ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОТИДОВ.
1. НУКЛЕОТИДЫ и АЗОТИСТЫЕ ОСНОВАНИЯ (АО), поступающие с пищей, не включаются в НУКЛЕОТИДЫ и НУКЛЕИНОВЫЕ К-ТЫ организма.
55.
2. Клетки организма человека синтезируют предшественники НУКЛЕОТИДОВ. Исходя из этого, доказательств опасности употребления в пищу генно-инженерных продуктов в настоящий момент нет.
3. Помимо синтеза включаются механизмы реутилизации ПУРИНОВЫХ и ПИРИМИДИНОВЫХ оснований, образующихся при деградации нуклеиновых кислот.
4. Можно использовать аналоги ПУРИНОВ и ПИРИМИДИНОВ как антиканцерогенные вещества путём включения их в ДНК и РНК.
БИОСИНТЕЗ ПУРИНОВЫХ ОСНОВАНИЙ. Для биосинтеза ПУРИНОВЫХ оснований доносами атомов и атомных групп являются:

Для биосинтеза ПИРИМИДИНОВЫХ оснований донорами атомов и атомных групп являются АСП, ГЛУ, производные ФОЛИЕВОЙ кислоты. Распад НП происходит одинаково и в тканях, и в ЖКТ.

Окисление мочевой кислоты - окисление ПУРИНОВЫХ НУКЛЕОЗИДОВ.


56.

Мочевая кислота является конечным продуктом распада ПУРИНОВЫХ НУКЛ.

Уровень мочевой кислоты будет свидетельствовать об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи. При распаде ПИРИМИДИНОВЫХ оснований из них образуется:
l.B-аланин СО2 NH3 МОЧЕВИНА


